
2.结构:一个硅原子与4个氧原子形成4个共价键,即每个硅原子周围有4个氧原子,每个氧原子周围有2个硅原子;晶体中硅原子和氧原子以1:2组成空间立体网状结构,是原子晶体。
1.存在:天然SiO2也叫硅石,自然界中的石英玛瑙(含杂质的石英)的主要成分都是SiO2。。
5.用途:(1)良好的半导体材料(为什么?)
(2)太阳能电池
(3)计算机芯片
4.化学性质:常温下与F2、HF、NaOH反应:
加热时能与H2化合生成不稳定的氢化物。
3.物理性质:灰黑色,硬度大,熔沸点高,具有金属光泽。
2.结构:与金刚石的晶体结构类似,是正四面体型空间网状结构的原子晶体。
1.硅的存在:在自然界只有化合态,是一种亲氧元素(这与同主族的碳不同),一般以SiO2 或 的形式存在,在地壳中的含量仅次于氧。
6.四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
① 称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
② 在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③ 将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:
2PbCrO4+2H+=2Pb2++Cr2O72-+H2O
加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。则:
⑴ 写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
⑵ 用标准溶液滴定时所用的指示剂是 。(写试剂名称)
⑶ 计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
5.1966年,范克等人提出用H2O、SO2和I2为原料进行热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)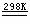 H2SO4(aq)+2HI(g) H2SO4(aq)
H2SO4(aq)+2HI(g) H2SO4(aq)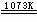 H2O(l)+ SO2(g)+
H2O(l)+ SO2(g)+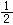 O2(g);
O2(g);
2HI(g) 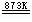 H2(g)+I2(g)
从理论上讲,该循环中,a mol原料水能制得氢气
H2(g)+I2(g)
从理论上讲,该循环中,a mol原料水能制得氢气
A.a mol B.0.5a mol C.0.25a mol D.2a mol
4.在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D.同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com