
28.
 向一定量的K2CO3溶液中缓慢地滴加稀盐酸并不断搅拌。随着盐酸的加入,溶液中各种离子的数目也相应地发生变化。如图所示,四条曲线与溶液中离子的对应关系,完全正确的是
向一定量的K2CO3溶液中缓慢地滴加稀盐酸并不断搅拌。随着盐酸的加入,溶液中各种离子的数目也相应地发生变化。如图所示,四条曲线与溶液中离子的对应关系,完全正确的是
A.a:Cl- b:K+ c:CO32- d:HCO3-
B.a:K+ b:CO32- c:Cl- d:HCO3-
C.a:K+ b:CO32- c:HCO3- d:Cl-
D.a:K+ b:HCO3- c:Cl-; d:CO32-
27.将两种硫酸盐按一定比例混合后共熔,制得化合物X,X溶于水后电离出K+、Cr3+、SO42-,将2.83g X中的Cr3+全部氧化为Cr2O72-后,Cr2O72-和过量KI溶液反应得到3.81 g I2,反应的离子方程式为:
Cr2O72- + 6I- + 14H+ = 2Cr3+ +3 I2 + 7H2O。
若向溶有2.83g X的溶液中加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3
D.K2SO4·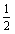 Cr2(SO4)3
Cr2(SO4)3
26.下列各组物质混合后,既产生无色气体,又产生白色沉淀的是
①Ba(NO3)2溶液跟NaHSO3溶液 ②Ba(OH)2溶液跟(NH4)2SO4溶液共热 ③电石跟苏打水,④三氯化铁溶液跟碳酸氢钠溶液
A.①②③ B.②③ C.①②③④ D.②③④
25.常温下,pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(忽略溶液混合过程中体积变化),则对反应后混合液的叙述正确的是
A.c(R2-)>c(Na+)>c(H+)=c(OH-)B.2c(R2-)+c(HR-)=c(Na+)
C.c(R2-)+c(OH-)=c(Na+)+c(H+)D.混合液的体积一定为2a L
24.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
23.25℃时,某溶液中由水电离的、并游离于溶液中的c(H+)=1×10-a mol·L-1。以下说法中正确的是
A.a>7时,此溶液中水的电离一定是受到了抑制
B.a <7是,此溶液中水的电离一定是受到了促进
C.a >7时,此溶液的pH为a或14-a
D.a <7时,此溶液的pH为a或14-a
22.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。浓度均为0.1mol·L-1的NaHSO3溶液和NaHCO3溶液中,各粒子的浓度存在下列关系(R表示S或C),其中正确是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH)-
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
21.常温下,pH=3的某酸HX稀溶液和pH=11的某碱YOH稀溶液混合后,溶液的pH大于7,下表判断合理的是
|
序号 |
HX |
YOH |
溶液的体积关系 |
|
A |
强酸 |
强碱 |
V(HX)>V(YOH) |
|
B |
强酸 |
强碱 |
V(HX)<V(YOH) |
|
C |
强酸 |
弱碱 |
V(HX)=V(YOH) |
|
D |
弱酸 |
强碱 |
V(HX)=V(YOH) |
20.常温下0.1mol·L-1一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
19.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com