
3.离子方程式的书写:
(1)书写规则:
①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。如Cl2、Na2O等不可以拆开写成Cl-、Na+、O2-;BaSO4不可以拆开写成Ba2+、SO42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。如NaHCO3改写Na+、HCO3-;NaHSO4应改写Na+,H+,SO42-
③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。如实验室制取NH3的离子方程式为:
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
⑤浓H2SO4、浓H3PO4一般不拆开写成离子形式;HCl、HNO3无论浓稀,均应改写成离子符号。如Cu片与浓H2SO4反应的离子方程式为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(2)书写步骤(以CuSO4溶液与BaCl2 溶液反应为)
①写出反应的化学方程式:CuSO4+BaCl2==CuCl2+BaSO4↓
②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。上述化学方程式可改写成:
Cu2++SO42-+Ba2+ +2Cl- =Cu2++2Cl-+BaSO4↓
③删去方程式两边不参加反应的离子符号:Ba2+ + SO42- =BaSO4↓
④检查离子方程式两边各元素的原子个数和电荷总数是否相等。
|
特别提醒: 常见离子方程式的书写错误 (1)不配平(一般表现为等式两边原子不守恒或电荷数不守恒)。如Fe3++Cu =Cu2++Fe2+; Na+H2O=Na++OH-+H2↑ (2)该改的不改或不该改的改了。如Na2O溶于水:O2- + H2O = 2OH-;大理石和稀盐酸反应:CO32-+2H+=CO2↑+H2O;醋酸铵溶液与烧碱溶液共热:CH3COONH4+OH- =CH3COO-+ NH3↑+H2O;乙醛做银镜反应:CH3CHO+2[Ag(NH3)2]OH→CH3COO-+NH4++2Ag↓+3NH3+H2O等等…… (3)与反应事实不相符合。如铁片溶于稀HCl:2Fe+6H+ =2Fe3++ 3H2↑;铝条溶于稀HNO3:2Al+6H+ = 2Al3++3H2↑ (4)不是离子反应的写离子方程式。离子反应发生在水溶液中或熔融状态下,否则就不能写离子方程式。如浓硫酸与食盐共热制HCl;浓硫酸与Cu共热制SO2;实验室制CH4和NH3等都无离子方程式。   (5)乱用↑、↓、 、
符号。如FeCl3溶液的水解:Fe3+
+ 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH- (5)乱用↑、↓、 、
符号。如FeCl3溶液的水解:Fe3+
+ 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH-  (6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。如Na2S溶于水:S2-+2H2O H2S +2OH-
;H2S溶于水:H2S 2H+
+ S2-。 (6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。如Na2S溶于水:S2-+2H2O H2S +2OH-
;H2S溶于水:H2S 2H+
+ S2-。(7)漏写一种产物。如CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓;Ba(OH)2溶液中滴加稀H2SO4:H+ + OH- = H2O。 (8)随便约简或不约简。如Ba(OH)2溶液不断滴加稀H2SO4:Ba2++H++OH-+SO42-=BaSO4↓+ H2O;Al2(SO4)3溶液中加氨水:2Al3+ +6NH3·H2O=2Al(OH)3↓+6NH4+ |
[例2](2008·上海)下列离子方程式书写正确的是( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+==CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O
[解析]CH3COOH为弱电解质,不可拆开写成离子形式,故C不正确;因加入的NaHSO3溶液少量,则在反应中Ba(OH)2过量,书写离子方程式时应以少量的NaHSO3为主,其离子方程式应为:HSO3-+Ba2++OH-==BaSO3↓+ H2O,故D不正确。
[答案]A B
考点三 溶液中的离子共存
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.强电解质、弱电解质
|
|
强电解质 |
弱电解质 |
|
定义 |
在水溶液中能全部电离的电解质 |
在水溶液中只能部分电离的电解质 |
|
电离程度 |
完全 |
部分 |
|
电离平衡 |
不存在 |
存在 |
|
溶液中存在微粒种类 |
水合离子、水分子 |
水合离子、水分子 弱电解质分子 |
|
电离过程 |
不可逆、不存在电离平衡 |
可逆、存在电离平衡 |
|
相互关系 |
均为电解质。在相同条件下,强电解质溶液的导电能力强于弱电解质溶液 |
|
|
电离方程式 书写规律 |
用等号 HnA=nH++An- |
用可逆符号,弱酸分步电离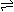 HnA H+
+HA(n-1)- HnA H+
+HA(n-1)-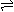 HA(n-1)- H+
+H2A(n-2)- HA(n-1)- H+
+H2A(n-2)- |
|
举例 |
强酸:HCl H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 绝大部分盐:BaSO4 BaCl2. 等 |
弱酸:CH3COOH
HCN H2S H2CO3等 弱碱:NH3H2O Cu(OH)2等. H2O及小部分盐:(CH3COO)2Pb等. |
[例1]下列物质属于电解质的是( )
A.Na2O B.SO3 C.Cu D.NaCl溶液
[解析] Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
[答案]A
|
特别提醒: 1.电解质是指在水溶液中或熔融状态下能够导电的化合物。水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。 2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。 3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。 |
考点二 离子方程式的书写
1.电解质、非电解质
|
|
电解质 |
非电解质 |
|
定义 |
在水溶液中或熔融状态下 能导电的化合物 |
在水溶液中和熔融状态下 均不能导电的化合物 |
|
本质 |
在水溶液中或熔融状态下 能够电离的化合物 |
在水溶液中和熔融状态下 均不能发生电离的化合物 |
|
导电实质 |
产生了自由移动的离子 |
没有产生自由移动的离子 |
|
结构特点 |
离子化合物和某些具有极性键 的共价化合物 |
某些共价化合物 |
|
共同点 |
均为化合物 |
|
|
注意点 |
电解质非、电解质的区分与化合物的水溶性无关. |
|
|
举例 |
NaCl Ba(OH)2 CH3COOH |
CH3CH2OH C12H22O11 |
34.2008年1月中旬至2月上中旬,一场50年一遇、个别地区达百年一遇的低温、雨雪、冰冻、灾害性天气袭击了我国南方地区。此次极端天气强度大,影响范围广、持续时问长,造成灾害之重为历史罕见,给人民群众生产生活带来严重影响.据此结合图11完成下列问题。
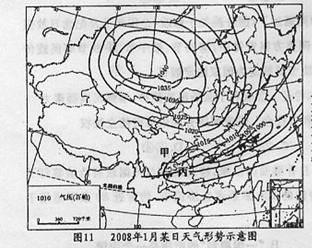
(1)冻害期间,控制乙地区的主要天气系统是:___________。
该天气系统活动过程中,冷空气势力特别强大的原因是:___________。
(2)图11中,甲地区与乙地区纬度位置相当,但甲地区受灾程度较轻;丙地区比甲地区纬度位置更低,但丙地区受灾反而更严重。试分别说明其原因。
(3)次生灾害是指由主灾诱发出来的其他灾害,具有隐蔽性和突发性的特点,危害极大。此次低温、雨雪、冰冻灾害可能诱发的次生灾害有(双选)( )
A.土地荒漠化 B.滑坡、泥石流等地质灾害
c.拉尼娜现象 D.水污染和土壤污染
33.读我国主要煤矿发布图,回答

(1)我国煤矿集中分布的地区在哪里?
(2)图中甲地区优势资源转化为经济优势面临的主要问题是什么?解决措施是什么?
(3)列举我国中部经济地带在丰富的煤矿和铁矿石基地附近建立的大型钢铁基地名称。
32.读下图,回答下列问题
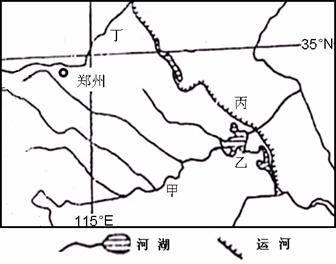
(1)简述甲河流域的地势特点。
(2)选择:郑州所属在的流域( )
A.黄河流域 B.海河流域 C.淮河流域 D.汉江流域
(3)郑州是重要的铁路枢纽,写出通过郑州的重要铁路线名称。
(4)上图乙地区周围是我国重要的商品粮基地,该地区成为商品粮基地的社会经济原因是什么?
(5)目前图中所示河流丙、丁内河航运量小的原因是什么?
(6)分析图中乙湖泊面积不断缩小对周围自然环境产生的不利影响。
31.读柴达木盆地示意图,完成下列问题。
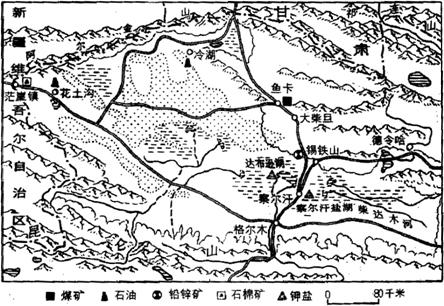
(1)概括图示地区交通线分布特点。
(2)从气候条件分析,盆地湖盐生产的有利条件是什么?
(3)柴达木盆地气温低、日变化大,这对农业生产有何影响?
30.在中央关于区域协调发展战略方针的指引下,“泛珠三角”――大致以珠江水系为纽带的南方9省区(粤、桂、湘、闽、赣、琼、川、滇、黔)加上港澳特区的区域经济,正以空前的速度和力度进行大整合。与我国其他地区相比,该区域内最丰富的资源是
①铁矿 ②稀土 ③有色金属矿 ④生物资源 ⑤水能 ⑥风能 ⑦水资源
A.①③⑤⑦ B.②④⑥⑦ C.③④⑤⑦ D.②③⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com