
3、25oC时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va< Vb,a=0.5b,请填写下列空白
①a值可否等于3 理由是: ,
②a值可否等于5 理由是: ,
③ a值的取值范围是: .
2、 若a代表Ba(OH)2溶液,b代表NaOH溶液,c代表NH3·H2O溶液,完成下列问题(用a、b、c表示)
(1)同物质的量浓度的三种溶液的pH大小为:_____________
(2)同pH的三种溶液物质的量浓度大小为:________________
(3)同pH时,三种溶液稀释相同倍数,pH大小为:___________
(4)同pH时,三种溶液稀释不同倍数后pH仍相同,(pH>7),则三种溶液稀释的倍数大小为:_______
(5)同物质的量浓度同体积的三种溶液消耗同浓度的盐酸的体积大小为:_____________
(6)同pH同体积的三种溶液消耗同浓度的盐酸的体积大小为:_____________
答案;a>b>c 2a=b<c a=b<c a=b<c a=2b=2c a=b<c
实质:稀释前后酸或碱的物质的量不变。一般计算公式:C1V1=C2V2,据此求出稀释后酸或碱的物质的量的浓度。
特殊结论:
⒈若为酸:
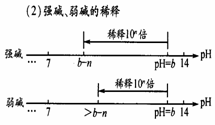
强酸,PH=a,稀释10n倍,PH=a+n ;
若为弱酸,PH=a,稀释10n倍,a< PH<a+n;
若酸的溶液无限稀释,则无论酸的强弱,PH一律接近于
⒉若为碱:
强碱,PH=a,稀释10n倍, PH=a-n;
弱碱,PH=a,稀释10n倍, a-n. < PH<a;
若碱的溶液无限稀释,则无论碱的强弱,PH一律接近于7。
例6. 下列六种情况下的PH分别为多少?
⑴PH=2的HCl溶液稀释1000倍,所得溶液的PH( )
⑵PH=2的CH3COOH溶液稀释1000倍,所得溶液的PH( )
⑶PH=2的HCl溶液稀释100倍,所得溶液的PH( )
⑷PH=11的NaOH溶液稀释100倍,所得溶液的PH( )
⑸PH=11的NH3·H2O溶液稀释100倍,所得溶液的PH( )
⑹PH=10的NaOH溶液稀释100倍,所得溶液的PH( )
解答:应用上述方法,不难得出正确答案分别为:
(1)5; (2)2<PH<5; (3)7; (4)9; (5)9<PH<11; (6)7。
例7.99 mL 0.5 mol/L硫酸跟101 mL1 mol/L氢氧化钠溶液混合后,溶液的pH值
A. 0.4 B. 2 C. 12 D. 13.6
解析:本题可按两种处理方法。
(1)可理解为99 mL 0.5 mol/L硫酸与99 mL 1 mol/L氢氧化钠完全反应,余下的2mL氢氧化钠溶液稀释为200mL,即[OH-]=1 mol/L×=0.01mol /L,pOH=12,pH=2。
(2)1 mol/L氢氧化钠溶液的pH=14,由(1)知,余下的2mL氢氧化钠溶液稀释为200mL,稀释了100倍,按照稀释规律,溶液的pH值要减小2个单位,(强酸溶液稀释10n倍,溶液的pH值增加n个单位,强碱溶液稀释10n倍,溶液的pH值减少n个单位)由14降到12,故应选C。
注:酸碱稀释的pH变化也可借助图像来帮助理解

①强酸溶液
强酸溶液的pH计算方法是:根据酸的浓度选求出强酸溶液中的c(H+)然后对其取负对数就可求得pH。
例1.求25℃时,0.005mol/L的H2SO4溶液的pH
解:0.005mol/L的H2SO4溶液中c(H+)=1×10-2故pH=2
②强碱溶液
强酸溶液的pH计算方法是:根据碱的浓度先求出强碱溶液中的c(OH-)然后利用该温度下的Kw求出c(H+)然后求pH
例2.求25℃时,10-5mol/L的NaOH溶液的pH
解:10-5mol/L的NaOH溶液中c(OH-)=1×10-5mol/L,则
c(H+)=Kw/c(OH-)=(1×10-14)/1×10-5mol/L=1×10-9mol/L,故pH=9
若题中改为100℃,则
c(H+)=Kw/c(OH-)=(1×10-12)/1×10-5mol/L=1×10-7mol/L,故pH=7
注:求强碱溶液pH的另一方法是先求出该溶液的pOH然后利用
pH+POH=-lg(Kw)求出pH
如10-5mol/L的NaOH溶液中c(OH-)=1×10-5mol/L,则pOH=5
故:25℃时,pH=14-pOH=9; 100℃时,pH=12-pOH=7
③其它溶液
其它溶液的pH计算方法是:想办法求出溶液中的c(H+)然后取负对数
例3.求25℃时,某浓度的HAC溶液中,由水电离的c(H+)=1×10-12mol/L,求该溶液的 pH
解:由题中水电离的c(H+)=1×10-12mol/L可得c(OH-)=1×10-12mol/L,则溶液中的c(H+)=1×10-14/1×10-12mol/L=1×10-2mol/L,故pH=2
例4.求25℃时,某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,求该溶液的 pH
解:由题中水电离的c(H+)=1×10-12mol/L可得溶液中的c(H+)=1×10-12mol/L故pH=12
例5.某地酸雨经检验除H+和OH-外,还含有Na+、Cl-、NH4+和SO42-等离子,其浓度:C(Na+)=7.0×10-6mol/L,C(Cl-)=3.5×10-5mol/L,C(NH4+)=2.3×10-5mol/L,C(SO42-)=2.5×10-6mol/L,则该酸雨的pH值为 。
解:由溶液中离子电荷守恒可得阴、阳离子电荷相等关系式如下:
C(Na+)+C(NH4+) +C(H+)=2(SO42-)+C(Cl-)+C(OH-),
C(H+)-C(OH-)=2×2.5×10-6mol/L+3.5×10-5mol/L-7.0×10-6mol/L-2.3×10-5mol/L
=1.0×10-5mol/L,
又 C(H+)×C(OH-)=1×10-14 mol/L 故pH=5。
5. 很遗憾,你错过了最后的截止日期。
4. 千年之后地球的居民可能可以用生态系统(ecological system)来处理垃圾。
3. 值得赞扬的是,他们通过努力和平的解决了那场冲突。
2. 这条线穿过格林尼治(Greenwich),萍玉就跨着这条线拍了一张照片。
(过去分词作宾语补足语)
1. 无论是霍乱(cholera)的病因还是治疗方法都一无所知。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com