
1.CD 2.A 3.
讲析:1. A不正确。关键词“不同原子”要注意,因为许多元素都有同位素,若是同种元素的不同原子,如氯元素有35Cl、37Cl两种氯原子,构成氯单质的氯气分子,可能是35Cl-35Cl、35Cl-37Cl、37Cl-37Cl,他们仍属于纯净物中的单质,不属于化合物;若是不同种元素的原子组成的纯净物,则一定是化合物。B前半句不正确。因非金属氧化物可能是不成盐氧化物(CO、NO等),它们既不能跟碱反应生成盐和水,也不能跟酸反应生成盐和水。前半句反过来也不正确,如Mn2O7的相应水化物为HMnO4,所以Mn2O7是酸性氧化物,但它是金属氧化物。B后半句正确,但后半句反过来就不正确了,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。C正确。含金属元素的离子,例如:K+、[Ag(NH3)2]+、AlO2-、MnO4-等,说明金属元素也可以构成阴离子。D正确。结晶水合物有固定的化学组成,属纯净物而不是混合物。胆矾和无水CuSO4不是同一种物质,无论是胆矾分解成无水CuSO4,还是无水CuSO4水合成胆矾,都是化学变化过程。2.化学变化与物理变化的本质区别是:是否有新物质生成。甘油稀释后仍具有吸湿性,可做护肤剂,该过程中不涉及化学变化;明矾溶于水后,发生反应Al3++3H2O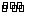
Al(OH)3 +3H+,产生了Al(OH)3胶体,从而可净化水;烹鱼时加入少量的料酒和食醋可减少腥味,增加香味的原因是过程中发生了CH3COOH+C2H5OH→CH3COOC2H5+ H2O,产生了具有果香味的乙酸乙酯的缘故;烧菜用过的铁锅,由于在潮湿的环境中发生了电化腐蚀,Fe最终被氧化成Fe2O3·nH2O,而出现红棕色斑迹。后三者都是化学变化过程。
5.(泰兴市第一高级中学2009届高三年级第五次周考)(10分)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后反应的离子方程式为______________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:________
______________________________________________________________________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是因为__________(选填序号)
a. 熔点较低(29℃熔化) b. 能导电 c. 能制冷 d. 无毒
4.(江苏省盐城市重点中学高中2009届第一协作片联考)将NaCl和NaBr的混和物mg溶于足量的水配成500mL的溶液A,再向其中通入足量的氯气,充分反应后蒸发至干,得干燥晶体(m-2)g,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能为[D ]
A.3︰2︰1 B.3︰1︰2 C.4︰3︰1 D.3︰1︰4
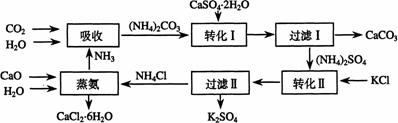
3.(江苏省盐城市重点中学高中2009届第一协作片联考)如图所示,锥形瓶中加入亚硫酸钠固体和1︰l的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是[C ]
2.
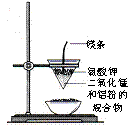
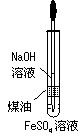 (江苏省盐城市重点中学高中2009届第一协作片联考)用下列装置能达到有关实验目的的是[BC ]
(江苏省盐城市重点中学高中2009届第一协作片联考)用下列装置能达到有关实验目的的是[BC ]

甲 乙 丙 丁
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰 D.用丁图装置验证NaHCO3和Na2CO3的
|
|
(1) |
(2) |
(3) |
|
A |
褪色 |
褪色 |
变红 |
|
B |
变红 |
变红 |
褪色 |
|
C |
变红 |
褪色 |
褪色 |
|
D |
褪色 |
变红 |
褪色 |
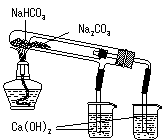
1.(江苏省盐城市重点中学高中2009届第一协作片联考)(8分)某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。
 步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
⑴为除去广口瓶中的氧气,燃烧匙中应装入下列试剂中的 ▲ (填序号)。
A.炭粉 B.硫粉 C.红磷
⑵“步骤2”中调节内外液面相平的方法: ▲ 。
⑶写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式: ▲ 。
⑷某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是 ▲ 。
答案:⑴C ⑵向水槽中加水 ⑶Mg3N2+8HCl=3MgCl2+2NH4Cl
⑷氧气比氮气活泼,与镁反应生成MgO
5.还原法:C+H2O CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2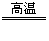 Si+2CO↑
Si+2CO↑
试题枚举
[例1] (1)氰化钾、氰化氢的制备反应式为:K2CO3+C+2NH3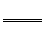 2KCN+3H2O;△H=+276kJ/mol
①
2KCN+3H2O;△H=+276kJ/mol
①
CO+NH3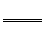 HCN+H2O;△H=+46kJ/mol
②
HCN+H2O;△H=+46kJ/mol
②
氰离子为负一价(CN-),其中碳氮元素的化合价分别为________。 以上两个反应是否均为氧化还原反应?(2)制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式。②为什么要磨细和用粉末?③为什么要强调适度加热?
解析:据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS
 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS HCN↑+K2S。
HCN↑+K2S。
[例2] 金属M可以在不同条件下发生下列五个反应:M+A→I M+B→H M+C→H+F M+D→H+A M+E→I+G 其中(1)A、B、C、D、E在通常情况下都是气体,并且C是CO 2。(2)上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C A +G→E,(3)I是一种离子化合物,它可以水解产生一种白色沉淀和E。该白色沉淀加热可 分解为H和H2O。而E则是分子晶体,其分子中共有10个电子,根据以上条件,判断并写出 有关物质的化学式:A________,B________,C________,D________,E________,F________,G________,H________,I________,M________。
解析: 本题的突破口是M+C→H+F,而C为CO2。一般同CO2能发生反应的金属就现有知识来讲,只能是Mg。F、H中有一为碳,根据F+B→C,则C为CO2,B为气体,F肯定为碳,H为MgO。扫描全题,得知E是分子晶体,且其分子中共有10个电子。分子中有10个电子的有:HF、H2O、NH3、CH4等。而E又通过一种离子化合物水解而得到,E可能为 HF或NH3。如E为HF,根据M+E→I+G,HF同Mg作用,但事实HF同Mg不反应。如为NH3同样根据A+G→E,A为N2或H2。因为Mg可跟A作用,显然A为N2,I为Mg3N2。再根据M+D→H+A,M为Mg,H为MgO,A为N2,则D只能为NO2。
答案:A:N2,B:O2,C:CO2,D:NO2,E:NH3,F:C,G:H2,H:MgO,I:Mg 3N2,M:Mg。
4.氧化法:如MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
2.分解法:如2KClO3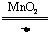 2KCl+3O2↑
CH4
2KCl+3O2↑
CH4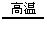 C+2H2
2H2O2
C+2H2
2H2O2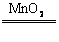 2H2O+O2↑
2H2O+O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com