
3. 汉代器物上的颜料“汉紫”至今尚未发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式为BaCuSi2Ox,Cu为+2价),下列有关“汉紫:的说法不正确的是 ( )
A.用盐的形式表示为BaSiO3·CuSiO3 B.用氧化物形式表示为BaO·CuO·SiO2
C.易溶于强酸、强碱 D.性质稳定,不易褪色
答案:A
2. 根据陈述的知识,类推得出的结论正确的是 ( )
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D.金刚石的硬度大,则C60的硬度也大
答案:.B
1.(2008广东)对于下列常见化学的认识错误的是 ( )
A. 明矾可用作净水剂
B. 干冰能用于人工降雨
C. 碳酸钙是文物陶瓷的主要成分
D. 小苏打是一种膨松剂,可用于制作馒头和面包
答案:C
8.(09浙江卷 28) 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
28) 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

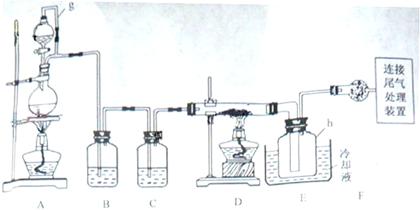
 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:


 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式
。
(1)写出装置A中发生反应的离子方程式
。

 (2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
(2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

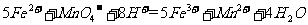
 ①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由 。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol·
L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol·
L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
 答案 (1)MnO2
+ 4H+ + 2Cl-
答案 (1)MnO2
+ 4H+ + 2Cl- Mn2+
+ Cl2↑ + 2H2O
Mn2+
+ Cl2↑ + 2H2O
 (2)平衡压强 浓硫酸 使SiCl4 冷凝
(2)平衡压强 浓硫酸 使SiCl4 冷凝
 (3)Al、P、Cl
(3)Al、P、Cl
 (4)①否;KMnO4溶液自身可作指示剂;
(4)①否;KMnO4溶液自身可作指示剂;
 ②4.480%
②4.480%
 解析 制备四氯化硅的原料为Cl2和Si。A装置为Cl2的制备装置,B、C装置为除杂装置。先B除去HCl,再用C(浓H2SO4)除去H2O蒸气。Cl2通入粗硅中反应,用冷水将产生SiCl4冷凝即可。
解析 制备四氯化硅的原料为Cl2和Si。A装置为Cl2的制备装置,B、C装置为除杂装置。先B除去HCl,再用C(浓H2SO4)除去H2O蒸气。Cl2通入粗硅中反应,用冷水将产生SiCl4冷凝即可。
(1)制取氯气用浓盐酸和MnO2在加热条件下反应。
(2)g管是将分液漏斗与烧瓶相连,则它们中的压强是相待的,这样便于盐酸能顺利滴下。SiCl4的沸点很低,只有57.7℃,而反应的温度达几百度,故需要冷凝收集。
(3)从物质的物理性质表可发现,AlCl3,FeCl3和PCl5均易升华,故还应还有Al、P、Cl元素。
(4)由于高锰酸钾本身是紫红色的,与Fe2+反应时,可以褪色,故而可以作为指示剂。根据方程式可以找出关系,5Fe2+~MnO4- ,n(Fe)= 10-2×20×10-3×5×100/25 =4×10-3mol。W (Fe)= 4×10-3×56/5 ×100% =4.48%。

7. (09全国卷Ⅰ29) 已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 ;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
答案 (1)原子晶体。
(2)NO2和N2O4
(3)As2S5。
(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;
②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。
(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4

 解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
(1)SiO2为原子晶体
(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。
(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。
(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形
(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
6. (08年江苏化学·18)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
 (1)下列措施中,有利于降低大气中CO2浓度的有:
。(填字母)
(1)下列措施中,有利于降低大气中CO2浓度的有:
。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2
+ 6H2O C6H12O6+6O2 b.CO2
+ 3H2
C6H12O6+6O2 b.CO2
+ 3H2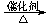 CH3OH +H2O
CH3OH +H2O
c.CO2
+ CH4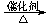 CH3COOH
d.2CO2 + 6H2
CH3COOH
d.2CO2 + 6H2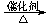 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
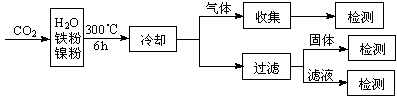
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:
 HCOOH是CO2转化为CH4的中间体,即:CO2
HCOOH是CO2转化为CH4的中间体,即:CO2 HCOOH
HCOOH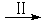 CH4
CH4
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
答案:(1)abcd (2)a c
(3)①3Fe+4H2O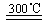 Fe3O4+2H2 ②c ③e
Fe3O4+2H2 ②c ③e
5.
 (09安徽理科基础
(09安徽理科基础 22)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
( )
22)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
( )
 A.石墨烯与石墨互为同位素
A.石墨烯与石墨互为同位素
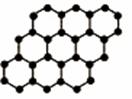
 B.0.12g石墨烯中含有6.02*1022个碳原子
B.0.12g石墨烯中含有6.02*1022个碳原子
 C.石墨烯是一种有机物
C.石墨烯是一种有机物
 D.石墨烯中的碳原子间以共价键结合
D.石墨烯中的碳原子间以共价键结合
 答案 D
答案 D
 解析 同位素的研究对象是原子,A选项错误;0.12g石墨烯的物质的量为0.01mol,所含碳原子个数为0.01NA,B选项错误;有机物一般含有碳、氢元素,C选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D选项正确。
解析 同位素的研究对象是原子,A选项错误;0.12g石墨烯的物质的量为0.01mol,所含碳原子个数为0.01NA,B选项错误;有机物一般含有碳、氢元素,C选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D选项正确。
4. (09广东理科基础 22)下列关于硅单质及其化合物的说法正确的是
( )
22)下列关于硅单质及其化合物的说法正确的是
( )
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素
 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维
 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①②
B.②③
C.①④ D.③④
A.①②
B.②③
C.①④ D.③④
 答案 A
答案 A
 解析 光导纤维的成分是SiO2,③错;陶瓷的成分是SiO2,而不属于硅酸盐,④错。故A项正确。
解析 光导纤维的成分是SiO2,③错;陶瓷的成分是SiO2,而不属于硅酸盐,④错。故A项正确。
3.(08年上海化学·22)在石灰窑中烧制生石灰,1 molCaCO3完全分解所需要的能量,可燃烧0.453 mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是 ( )
A.0.43 B.0.46 C.0.49 D.0.52
答案:AB
2. (2007年高考海南化学卷,硅)下列物质中,不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
答案:B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com