
3. 一物体做匀变速直线运动.当t=0时,物体的速度大小为12 m/s,方向向东,当t=2 s时,物体的速度大小为8 m/s,方向仍向东,则当t为多少时,物体的速度大小变为2 m/s( )
A.3 s B.5 s C.7 s D.9 s
解析:a===-2 m/s2,故t′===5 s或7 s.
答案:BC

图1-1-9
2. 在2008年央视开年大戏《闯关东》中,从山东龙口港到大连是一条重要的闯关东路线.假如有甲、乙两船同时从龙口出发,甲船路线是龙口--旅顺--大连,乙船路线是龙口--大连.两船航行两天后都在下午三点到达大连,以下关于两船全航程的描述中正确的是( )
A.两船的路程相同,位移不相同
B.两船的平均速度相同
C.“两船航行两天后都在下午三点到达大连”一句中,“两天”指的是时间,“下午
三点”指的是时刻
D.在研究两船 的航行时间时,可以把船视为质点
的航行时间时,可以把船视为质点
解析:在本题中路程是船运动轨迹的长度,位移是龙口指向大连的有向线段,两船的路程不相同,位移相同,故A错误;平均速度等于位移除以时间,故B正确;时刻是指某一瞬间,时间是两时刻间的间隔,故C正确;在研究两船的航行时间时,船的大小和形状对所研究的问题影响可以忽略不计,故D正确.
答案:BCD
1.小明周末到公园坐摩天轮(如图1-1-8所示),已知该轮直径为80 m,经过20 min转动一周后,小明落地,则小明在摩天轮上的平均速度为( )
A.0.2 m/s B.4 m/s C.0 D.非直线运动,不能确定
解析:平均速度是指位移和所用时间的比值,与直线运动或曲线运动无关.小明在摩天轮上转动一周,总位移为零,故其平均速度为零,C正确.
答案:C
14.(13分)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行探究:
 (1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出有关反应的离子方程式________________________________________________________________________
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出有关反应的离子方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________.
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一回答:
①若不是原电池,请说明原因:________(如果回答此题,下面的②不用回答).
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是____________________________________.
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:________________________________________________________________________
________________________________________________________________________.
解析:(1)铁丝和碳棒做两极,分别针对两极产物Fe2+和OH-进行检验.
(2)具备构成原电池的基本条件,在正极上发生还原反应的是空气中的O2.
(3)在众多限制下,只能考虑电化学保护法.
答案:(1)用导线连接铁丝和碳棒后,插入盛有20%的NaCl溶液的U形管中,放置数分钟.取插入铁丝的支管中的液体少许于试管中,滴入1-2滴KSCN溶液,未显红色,滴入氯水显红色,证明负极有Fe2+生成:2Fe2++Cl2===2Cl-+2Fe3+;Fe3++3SCN-Fe(SCN)3.在插入碳棒的支管中滴入酚酞溶液,碳棒周围溶液显红色,证明有OH-生成
(2)②向插碳棒的溶液中通入氧气或空气
(3)将铁块(或锌块)连接文物底座并埋于地下,定期更换;原理是:使文物成为原电池的正极
(或向铜文物用导电连接直流电源的负极,正极用导线连接埋入地下的导体.原理是:使文物成为电解池的阴极)
13. (11分)某研究性学习课题组为探究影响钢铁生锈的因素,
(11分)某研究性学习课题组为探究影响钢铁生锈的因素,
设计了如下的方案:在四只小烧瓶中分别放入下列物质:A
瓶干燥的细铁丝、B瓶浸过食盐水的细铁丝、C瓶浸过清水
的细铁丝、D瓶食盐水及细铁丝,并使铁丝完全浸没在食盐
水中.然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,
结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
不同时间水面上升的高度
|
时间/h 高度 瓶号 |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
|
A瓶(盛干燥细铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
B瓶(盛浸过食盐水 |
|
|
|
|
|
|
|
|
的细铁丝) |
0 |
0.4 |
1.2 |
3.4 |
5.6 |
7.6 |
9.8 |
|
C瓶(盛浸过清水 |
|
|
|
|
|
|
|
|
的细铁丝) |
0 |
0 |
0 |
0.3 |
0.8 |
2.0 |
3.5 |
|
D瓶(盛完全浸没在 |
|
|
|
|
|
|
|
|
食盐水中的细铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
课题组在解题时,学校评审组组织了成果展示与答辩,假如你是课题组组长,请回答以下的问题:
(1)导管中水面为什么会上升?______________________________________________
______________________________________________________________________.
(2)上述实验中,细铁丝生锈的速率由大到小的排列顺序为(填小烧瓶号)__________.
(3)影响钢铁生锈的因素主要有_______________________________________
________________________________________________________________________.
(4)为防止铁的锈蚀,工业上普遍采用的方法是_______________________________
________________________________________________________________________(答两种方法)
解析:细铁丝在清水或食盐水中,发生吸氧腐蚀,故导管中液面要上升.但要发生吸氧腐蚀的原电池反应,必须符合构成原电池的基本条件:①活泼性不同的电极互相接触.②电解质溶液.③有空气(或O2)且尽量与细铁丝和电解质接触.
为了防止铁的锈蚀,工业上普遍采用电化学保护法,可以作原电池的正极或电解池
的阴极,也可以用覆盖保护层的方法.
答案:(1)铁生锈时跟空气中的氧气反应,消耗了氧气而使小烧瓶中气体压强降低
(2)B>C>A=D
(3)①跟氧气接触,②有水分存在,③有电解质(或食盐存在,三者同时具备时铁生锈速度最快(或从构成原电池的条件分析)
(4)电镀等表面覆盖保护层法,牺牲阳极的阴极保护法等

12.(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____________________.
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应_______________________________________________________,
负极反应_____________________________________________________________.
(3)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显.请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.
有关反应的化学方程式____________________.
劣质不锈钢腐蚀的实验现象___________________________________________.
解析:(1)该反应是FeCl3氧化金属铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+.
(2)将(1)中反应设计成的原电池必须是Cu作负极,选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作电解质溶液.装置图如下图:
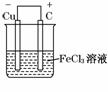
正极:2Fe3++2e-===2Fe2+
负极:Cu-2e-===Cu2+
(3)根据题给条件,此不锈钢在盐溶液中腐蚀明显,可选择的药品为CuO、浓H2SO4.先用水稀释浓H2SO4,再用H2SO4与CuO反应生成CuSO4溶液,不锈钢与CuSO4溶液反应,在不锈钢的表面有紫红色物质生成,即验证劣质不锈钢易被腐蚀.
答案:(1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下:

正极反应:Fe3++e-===Fe2+
(或2Fe3++2e-===2Fe2+)
负极反应:Cu-2e-===Cu2+
(3)CuO+H2SO4===CuSO4+H2O
CuSO4+Fe===FeSO4+Cu
不锈钢表面有紫红色物质生成
11.(13分)市场上出售的“热敷袋”其主要成分是铁屑、碳粉、木屑和少量氯化钠、水等.“热敷袋”启用之前,用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在.请回答下列问题:
(1)“热敷袋”放出的热量是利用了铁__________放出的热量;
(2)碳粉的主要作用是____________________________________________
____________________________________________________________________;
(3)加入氯化钠的主要作用是___________________________________________;
(4)写出有关的电极反应方程式______________________________、____________________________.
解析:解此题的关键条件是使用时要打开塑料袋与空气接触,这说明氧气参与了反应,从所给原料和产物上看,O2只能氧化铁粉.再由反应的条件:NaCl溶于水形成电解质溶液,铁、碳是两种活泼性不同的导体,O2作氧化剂,可知发生的反应是原电池反应,同时放出热量.
答案:(1)被氧化
(2)碳粉与铁屑、氯化钠溶液构成原电池,碳作正极,加速铁屑的氧化
(3)氯化钠溶于水,形成电解质溶液
(4)负极:2Fe-4e-===2Fe2+
正极:O2+2H2O+4e-===4OH-
10.下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
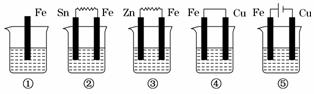
A.⑤②①③④ B.④③①②⑤
C.⑤④②①③ D.③②④①⑤
解析:判断金属腐蚀的快慢,首先判断该金属是否充当原电池或电解池的电极,若
是电解池的阳极,金属腐蚀速率最快,其次是充当原电池的负极腐蚀较快,而作为
电解池的阴极和原电池的正极则不被腐蚀.⑤中,Fe作为电解池的阳极,腐蚀最快,
②③④均为原电池,③中,Fe为正极,不被腐蚀,②④中Fe均为负极被腐蚀,Fe
和Cu的金属活动性差别比Fe和Sn大,故④中铁腐蚀较快,则铁被腐蚀的速率由
快到慢的顺序为⑤④②①③.
答案:C
9.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法错误
的是 ( )
A.正极电极反应式为:2H++2e-===H2↑
B.此过程中还涉及到反应:
4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中Cu并不被腐蚀
D.此过程中电子从Fe移向Cu
解析:铁、铜接触处在潮湿空气中发生吸氧腐蚀,其中Fe作负极,电极反应式为Fe-2e-===Fe2+,Cu作正极,电极反应式为O2+4e-+2H2O===4OH-,原电池反应为2Fe+O2+2H2O===2Fe(OH)2,但Fe(OH)2易与空气中的O2发生反应4Fe(OH)2+O2+2H2O===4Fe(OH)3.
答案:A
8. 某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下
实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食
盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实
验,过一段时间后观察.
下列现象不可能出现的是 ( )
A.B中导气管产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
解析:该题思考的切入点是铁-锌-NaCl溶液构成原电池,由于溶液显中性,锌又比铁活泼,只能是锌作负极,铁作正极,在负极上发生Zn-2e-===Zn2+,正极:O2+2H2O+4e-===4OH-,所以在A中由于其中的氧气作氧化剂而使锥形瓶内气体的量减小,导致B中的水沿导气管进入而使导气管里形成一段水柱,同时锌被腐蚀,金属片上由于O2得到电子,使金属片剪口处溶液c(OH-)增大,使得溶液显碱性,遇到酚酞试液而变红.故综合以上选A.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com