
8.在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是 ( )
A.c(HCOO-)<c(Na+) B.c(HCOO-)>c(Na+)
C.c(OH-)>c(HCOO-) D.c(OH-)<c(HCOO-)
7.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是 ( )
A c (Ac-)>c (Cl-)>c (H+)>c (HAc) B c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C c (Ac-)=c (Cl+)>c (H+)>c (HAc) D c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
6.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中( )
A c(HCOO-)>c(Na+) B c(HCOO-)<c(Na+)
C c(HCOO-)=c(Na+) D 无法确定c(HCOO-)与c(Na+)的关系
5.常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是 ( )
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
4.在10mL 0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.C(Na+)>C(Ac+)>C(H+)>C(OH+) B.C(Na+)>C(Ac)>C(OH-)>C(H+)
C.C(Na+)=C(Ac-)+C(HAc) D.C(Na+)+C(H+)=C(Ac-)+C(OH-)
3.将20ml0.4mol·L-1硝酸铵溶液跟50mL0.1mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 ( )
A.c(NO-3)>c(OH-)>c(NH4+)>c(Ba2+) B.c(NO-3)> c(Ba2+)> c(OH-)>c(NH4+)
C.c(Ba2+) > c(NO-3)>c(OH-)>c(NH4+) D.c(NO-3)> c(Ba2+)>c(NH4+)> c(OH-)
2.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN-) a+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol·L-1
例15?(1996年上海高考题)物质的量浓度相同的下列溶液中,NH4+浓度最大的是(??)。
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
解析:NH4+在溶液中存在下列平衡: NH4++H2O NH3·H2O+H+ B项NH4HSO4电离出大量H+,使上述平衡向左移动,故B中C(NH4+)大于A中的C(NH4+),C项CH3COO-和D项的HCO3-水解均呈碱性,使平衡向右移动,故C、D中C(NH4+)小于A中C(NH4+),正确答案为B。
NH3·H2O+H+ B项NH4HSO4电离出大量H+,使上述平衡向左移动,故B中C(NH4+)大于A中的C(NH4+),C项CH3COO-和D项的HCO3-水解均呈碱性,使平衡向右移动,故C、D中C(NH4+)小于A中C(NH4+),正确答案为B。
离子浓度大小比较强化训练
1.下列混合溶液中,各离子浓度的大小顺序正确的是 ( )
A.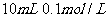 氨水与
氨水与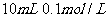 盐酸混合,
盐酸混合,
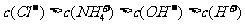
B.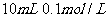
 溶液与
溶液与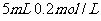
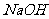 溶液混合,
溶液混合,

C. 溶液与
溶液与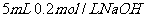 溶液混合,
溶液混合,
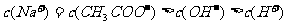
D.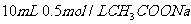 溶液与
溶液与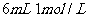 盐酸混合,
盐酸混合,
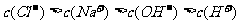
解题指导:此类问题与类型二第三种情况相似,反应到最后也一般为盐和酸(或碱)的混合物,分析时同样从盐溶液中弱离子水解和酸碱的电离相当强弱入手。
例13?(2001年上海高考题)将0?1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是(??)。?
A.C(CH3COO-)>C(Cl-)>C(H+)>C(CH3COOH) B.C(CH3COO-)>C(Cl-)>C(CH3COOH)>C(H+)
C.C(CH3COO-)=C(Cl-)>C(H+)>C(CH3COOH)? D.C(Na+)+C(H+)=C(CH3COO-)+C(Cl-)+C(OH-)
解析:两溶液混合反应后,溶液实质上是生成等浓度醋酸和醋酸钠、氯化钠的混合溶液。因溶液呈酸性说明CH3COO-的水解程度小于CH3COOH的电离程度,所以C(CH3COO-)>C(Cl-)>C(CH3COOH),但CH3COOH电离程度较小,C(CH3COOH)>C(H+),故选项A、C错,B正确。依据电荷守恒原则,可知选项D也正确。综合上述答案选B、D。
例14?(1997年全国高考题)0.1mol·L-1NaOH和0.1mol·L-1? NH4Cl溶液等体积混合后,离子浓度大小次序正确的是(??)。?
A.C(Na+)>C(Cl-)>C(OH-)>C(H+) B.C(Na+)=C(Cl-)>C(OH-)>C(H+)
C.C(Na+)=C(Cl-)>C(H+)>C(OH-) D.C(Cl-)>C(Na+)>C(OH-)>C(H+)
解析:两者混合恰好反应,产物为NaCl和NH3·H2O,显碱性,且C(Na+)=C(Cl-),故答案B。
对于酸碱中和的类型,应先考虑它们按化学计量关系进行反应,观察是否反应完全,然后考虑物质在水溶液中的电离及可能存在的电离平衡、水解平衡以及抑制水解等问题,最后对离子浓度大小作出估计和判断。
1?恰好中和型
解题指导:给定的酸碱是等物质的量的反应(注意与H+和OH-物质的量相等的情况区别)反应结束后一定是生成正盐和水,故可把此类问题转化成是正盐溶液中离子浓度比较问题,即单一溶质型中的溶质为盐的问题来解决。
例6?(2003年上海高考题)在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度HAC溶液,反应后溶液中各微粒的浓度关系错误的是(??)。?
A.C(Na+)>C(AC-)>C(H+)>C(OH-) B.C(Na+)>C(AC-)>C(OH-)>C(H+)
C.C(Na+)=C(AC-)+C(HAC) D.C(Na+)+C(H+)=C(AC-)+C(OH-)
解析:由于混合的NaOH与HAC物质的量都为1×10-3mol,两者恰好反应生成NaAC,等同于单一溶质,故与题型一方法相同。
由于少量AC-发生水解:
AC-+H2O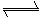 HAC+OH-
HAC+OH-
故有C(Na+)>C(AC-)>C(OH-)>C(H+),根据物料守恒C正确,根据电荷守恒D正确,A错误。故该题选项为A。
例7?(1998年全国高考题)等体积等浓度MOH强碱溶液和HA弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是(??)。?
A.C(M+)>C(OH-)>C(A-)>C(H+) B.C(M+)>C(A-)>C(H+)>C(OH-)
C.C(M+)>C(A-)>C(OH-)>C(H+) D.C(M+)+C(H+)=C(A-)+C(OH-)
解析:根据题意MOH与HA恰好反应生成强碱弱酸盐。因少量A-发生水解。A-+H2O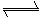 HA+OH-,A-减少,溶液呈碱性,故C正确;又根据电荷守恒D也正确。
HA+OH-,A-减少,溶液呈碱性,故C正确;又根据电荷守恒D也正确。
2?pH等于7型
解题指导:酸碱中和反应(注意与恰好中和型区别)结束后一定是C(H+)=C(OH-)故分析此类问题从两方面入手:
(1)考虑从电荷守恒入手求得其它离子相等关系。
(2)判断PH等于7时,酸碱到底谁过量;方法是:先设定为完全反应时的PH然后与PH=7比较便可得出。
例8?(2002年全国高考理综)常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中(??)。?
A.C(HCOO-)>C(Na+) B.C(HCOO-)<C(Na+)
C.C(HCOO-)=C(Na+) D.无法确定C(HCOO-)与C(Na+)的关系
解析:根据溶液中电荷守恒: C(Na+)+C(H+)=C(HCOO-)+C(OH-)因pH=7,故C(H+)=C(OH-),所以有C(Na+)=C(HCOO-),此题量的分析为:若完全反应生成甲酸钠为强碱弱酸盐,溶液呈碱性,而现在pH=7,故酸须略为过量。 答案为C。
例9?(2002年上海高考题)在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是(??)。
A.C(A-)=C(K+) B.C(H+)=C(OH-)<C(K+)<C(A-)
C.V后≥20mL D.V后≤20mL
解析:pH=10的KOH有C(KOH)=10-4mol·L-1,pH=4的一元酸,因不清楚是强酸还是弱酸,故有C(HA)≥10-4mol·L-1,根据电荷守恒,无论是强酸或是弱酸,都有下列关系:C(H+)+C(K+)=C(OH-)+C(H+),因pH=7,C(H+)=C(OH-),故C(A-)=C(K+),A选项正确,B错;当HA为强酸时,加入10mLKOH与HA刚好中和,pH=7,此时V后为20mL,当HA为弱酸时,有两种方法可以分析:
(1)假设两考等体积混合则,则电离出来的n(H+)和n(OH-)恰好反应完全但此时及有酸(pH=4时,酸的浓度大于1×10-4mol/L)pH<7,故为了使pH=7必须少加酸,故V后≤20m
(2)因C(HA)>10-4mol·L-1,故加入V(HA)<10mL即达pH=7,此时V后≤20mL,综合上述,V后≤20mL,D项也正确。
[变式训练]在常温下10mL 0.01mol/L的KOH溶液中,加入0.01mol/L的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是(??)。
A.C(A-)=C(K+) B.C(H+)=C(OH-)<C(K+)<C(A-)
C.V后≥20mL D.V后≤20mL
解析:同上题仍可得A是正确的,B是不正确的;当酸是强酸时两者等体积混合。V后=20mL
当酸是弱酸时同样分析如下:假设两考等体积混合,则酸碱恰好反应,些时溶液呈碱性pH>7为了使pH=7只能多加酸,故答案C也正确.
3?反应过量型
解题指导:先判断反应前后谁过量,及反应后各物质的量,再考虑电离或水解的情况.(1)当酸(碱)的电离大于盐溶液中弱离子水解时,可认为盐中的弱离了不水解,此时主要考虑电离对离子浓度造成的影响;反之可认为酸(碱)不电离(但实际有电离,程度很小),此时只考虑离子水解对离子浓度造成的影响。
例10?(2003年江苏高考题)将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是(??)。
A.C(HCN)<C(CN-) B.C(Na+)>C(CN-)
C.C(HCN)-C(CN-)=C(OH-) D.C(HCN)+C(CN-)=0.1mol·L-1
解析:将0.2mol·L-1 HCN溶液和0?1mol·L-1的NaOH溶液等体积混合后,C(CN-)=0.05mol·L-1,c(HCN)=0.05mol·L-1,由于混合后溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,故C(HCN)>C(CN-),A错。由上述分析知C(CN-)<0.05mol·L-1,而C(Na+)=0.05mol·L-1,B正确;根据C、N元素守恒可得C(HCN)+C(CN-)=0.1mol·L-1,故D项也正确;根据电荷守恒: C(OH-)=C(H+)+C(Na+)-(CN-) 故C不正确,综合上述正确答案为B、D。
例11?(1999年上海高考题)把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则溶液中粒子浓度关系正确的为(??)。
A.C(CH3COO-)>C(Na+) B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH) D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
解析:将0.02mol·L-1 CH3COOH和0.01mol·L-1NaOH溶液等体积混合后,混合液的溶质为CH3COOH和CH3COONa,且物质的量相等,浓度为5×10-3mol·L-1,由于CH3COOH电离趋势大于CH3COO-的水解趋势,所以C(CH3COO-)>C(Na+),但无论怎样变化,由物料守恒知:
C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
正确答案为A、D。
例12?(1996年全国高考题)将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度大小关系正确的是(??)。?
A.C(NH4+)>C(Cl-)>C(H+)>C(OH-) B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(H+)>C(OH-) D.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
解析:pH=3,C(HCl)=10-3mol·L-1,pH=11,C(OH-)=10-3mol·L-1,因氨水为弱电解质,所以C(NH3·H2O)>C(HCl),两者等体积混合后,氨水过量。因氨水电离程度大于NH4+水解程度。所以C(NH4+)>C(Cl-),同时也存在C(OH-)>C(H+),而NH3·H2O电离只是少数,所以存在C(Cl-)>C(OH-),故正确答案为B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com