
6.下列说法不正确的是( )。
A.焦炭在高温下与水蒸气的反应是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.化学反应的过程,都可以看成是“贮存”在物质内部的能量转化为热能等
而被释放出来的过程
5.下列反应属于吸热反应的是( )。
A.二氧化碳与赤热的碳反应生成一氧化碳 B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H20与NH4Cl反应 D.锌粒与稀H2S04反应制取H2
4.下列反应属于放热反应的是( )。
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳
3.能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断下列叙述正确的是
A.天然气是二级能源 B.石油是二级能源
C.电能是一级能源 D.水力是一级能源
2.吸热反应一定是( )。
A.释放能量 B.贮存能量
C.反应物总能量高于生成物总能量 D.反应物总能量低于生成物总能量
1.下列说法不正确的是( )。
① 化石燃料在任何条件下都能充分燃烧
② 化石燃料在燃烧过程中能产生污染环境的CO、S02等有害气体
③ 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
④ 固体煤变为气体燃料后,燃烧效率更低
A.①④ B.②③④ C.②③ D.①③④
5.沉淀的转化
(1)实验3-4在01.mol/LAgNO3溶液中滴加01.mol/LNaCl溶液,再滴加01.mol/LKI溶液,
又再滴加01.mol/LNa2S溶液,观察
|
步骤 |
NaCl和AgNO3溶液混合 |
向固体混合物中滴加01.mol/LKI溶液 |
向新固体混合物中滴加01.mol/LNa2S溶液 |
|
现象 |
|
|
|
(2)实验3-5向盛有1mL01.mol/LMgCl2溶液中滴1-2滴NaOH溶液,再滴加2滴.mol/LFeCl3溶液,观察
|
步骤 |
向MgCl2溶液中滴1-2滴NaOH溶液 |
向白色沉淀中加2滴.mol/LFeCl3溶液 |
|
现象 |
|
|
(3)对于一些用酸或其他方法也不能溶的沉淀,可先将其转化为另一种用酸或其他方法能溶解的 。
(4)水垢中含CaSO4的处理。先用 溶液处理,再用盐酸除去。


小结:沉淀的溶解的方法
常用的方法是:在难溶电解质饱和溶液中加入适当试剂使之与组成沉淀的一种构晶离子结合成另一类化合物,从而使之溶解。具体办法可采用酸碱溶解法、配位溶解法、氧化还原溶解法以及沉淀转化溶解法等。
(1) 酸碱溶解法
难溶酸常用强碱来溶解:H2SiO3(S)+2NaOH=Na2 SiO3+2H2O
难溶弱酸盐常用强酸或较强酸来溶解:CaC2O4(S)+2HCl= CaCl2+H2C2O4
难溶碱常用强酸(也可用较弱酸)来溶解:例如,向Mg(OH)2 沉淀中,加入酸或铵盐
(2) 发生氧化还原反应使沉淀溶解
有些金属硫化物如等,(CuS、HgS等)其溶度积特别小,在饱和溶液中C(S2-)特别少,不能溶于非氧化性强酸,只能溶于氧化性酸,以至减少C(S2-),达到沉淀溶解的目的。如:
3CuS+8HNO3=3Cu(NO3)+3S↓+2NO↑+4H2O
(3) 生成配合物使沉淀溶解:AgCl加氨水稳定的配合物[Ag(NH3)4]+减少其离子浓度,从而使沉淀溶解。
(4)沉淀转化溶解法:BaSO4的溶解。它不能为酸碱所溶解,又不易形成稳定的配离子,也不具有明显的氧化还原性,唯一的办法就是把它转化为一种新的难溶盐-弱酸钡盐(常使之转化为BaCO3),然后使之再溶于强酸。
试题枚举
[例1]298K,AgCl的溶解度为1.79×10-3g·L-1,试求该温度下AgCl的溶度积。
解析:已知AgCl的相对分子质量为143.4,则
AgCl溶解度为; =1.25×10-5(mol·L-1)
则: C(Ag+)=C(Cl-)=1.25×10-5mol·L-1
∴={C(Ag+/){C(Cl-)/}=(1.25×10-5)2=1.56×10-10
[例2]298K时,Ag2CrO4的为9.0×10-12,求算Ag2CrO4的溶解度。
解析: Ag2CrO4(s) 2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
设s为该温度下的溶解度(mol·L-1) 则:C(CrO42-)=s,C(Ag+)=2s
={C(Ag+)/}2{C(CrO42-)/}
=(2s)2·x=9.0×10-12
s=1.31×10-4(mol·L-1)
从上二例可知:AgCl 的比Ag2CrO4 的大,但AgCl的溶解度反而比Ag2CrO4的小,这是由于两者的溶度积表示式类型不同。由此得出结论:虽然也可表示难溶电解质的溶解能力大小,但只能用来比较相同类型的电解质,即阴离子和阳离子的总数要相同。
4.沉淀的溶解
(1)对于在水中难溶的 ,如果能设法不断移去溶解平衡体系中的相应 ,使平衡向沉淀溶解的方向 ,就可以使沉淀溶解。
(2)CaCO3沉淀溶于盐酸中
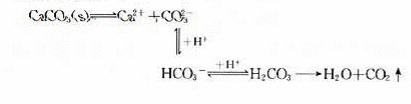
在上述反应中,CO2的生成和逸出,使CaCO3溶解平衡体系中的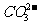 浓度不断 ,平衡向
方向移动。
浓度不断 ,平衡向
方向移动。
(3)向3支盛有少量Mg(OH)2试管中分别滴加适量的蒸馏水、盐酸、氯化铵溶液,观察现象
|
滴加试剂 |
蒸馏水 |
盐酸 |
氯化铵溶液 |
|
现象 |
|
|
|
|
有关反应式 |
|
|
|
3.沉淀反应的应用
(1)在某些工业领域中,常用生成 来达到分离或除去某些离子的目的。
(2)如何除去工业原料氯化铵中的杂质氯化铁?
(3)要除去某溶液中的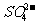 离子,加入可溶性钙盐还是钡盐?为什么?
离子,加入可溶性钙盐还是钡盐?为什么?
(4)判断能否生成沉淀应从哪几个方面考虑?是否可以使要除去的离子全部通过沉淀除去?
2.溶解平衡的特征:
生成沉淀的离子反应的本质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com