
7.(08山东省威海市08质量检测)下列有关离子浓度及pH的大小比较,正确的是 ( D )
A.NH4+浓度相同的下列溶液,①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B.由pH=3的HAc与pH=11的NaOH溶液等体积混合,其离子浓度不可能是
c(Ac-)>c(Na+)>c(H+)>c(OH-)
C.pH=13的Ba(OH)2与pH=1的HCl溶液等体积混合后,混合液的pH>7
D.将pH=12的Ba(OH)2与pH=14的NaOH溶液等体积混合后,混和液13<pH<14
5.(08山东省威海市模拟)下列判断正确的是 ( )
A.加入铝粉后产生氢气的溶液中可能大量共存NH4+、Na+、NO3-、S2-
B.25℃时,将氨水逐滴加入到稀H2SO4中至溶液pH=7:c(NH4+)=c(SO42-)
C.0.1mol/LK2CO3溶液中,加入一定量的水可使c(CO32-)更接近0.1mol/L
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
 6(08山东省威海市模拟).下列图像正确反映所对应实验的是 ( )
6(08山东省威海市模拟).下列图像正确反映所对应实验的是 ( )
A.①为向pH=13的NaOH溶液中不断加水
B.②为向MnO2中加入一定量的H2O2溶液
C.③为向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.④为将氨气通入醋酸溶液中
4.(08山东省潍坊一中高三4月模拟测试)今有室温下四种溶液,有关叙述正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后, ①溶液的pH减小, ②溶液的pH不变
B.温度下降10℃,①、②、③、④四种溶液的pH均不变
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
3. (08山东临沂质量检测一) 室温下,甲溶液中水电离出的H+浓度为10-12 mol /L, 乙溶液中水电离出的H+浓度为10-2 mol /L,下列说法正确的是
A. 甲乙两溶液的pH不可能相同
B. 甲乙两种溶液中加入Al粉都一定会产生H2
C. HCO3-不可能在甲、乙两溶液中大量共存
D. 甲不可能是盐溶液 , 乙不可能是酸或碱溶液
2. (08山东临沂质量检测一) 下列叙述正确的是
A. 0.01 mol /L CH3COOH与pH = 12的NaOH溶液混合,若c(CH3COO-) >c(Na+)混合液一定呈碱性
B. 常温下,将等体积0.0lmo/L HCl和pH = 12的氨水混合,则混合液的pH <7
C. 0.0lmol/L的某二元弱酸盐Na2A溶液中,c( Na+)= c(H2A) + c( HA-)+ (A2- )
D. 将5mL0.02mol/L的H2SO4与5 mL 0.02mol/L NaOH溶液充分混合,若混合后溶液的体积为10mL, 则混合液的pH =2
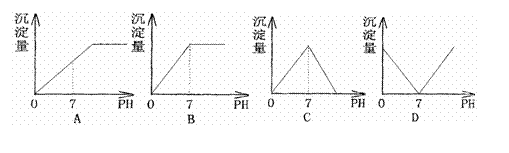
1、(08山东省沂水三中第二次诊断性).向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的pH变化情况正确的是 ( A )
例4 根据以下叙述,回答1-2小题。1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。
有关反应为:
O3 O2+O Cl+O3→ClO+O2 CIO+O→CI+O2
O2+O Cl+O3→ClO+O2 CIO+O→CI+O2
总反应:2O3→3O2
1.在上述臭氧变成氧气的反应过程中,Cl是( )
A.反应物 B.生成物 C.中间产物 D.催化剂
2.O3和OZ是( )
A.同分异构体 B.同系物 C.氧的同素异形体 D.氧的同位素
[解析] 本题以环保问题为题材。信息内容起点较高,但落点却很低,只考查了中学化学中的几个基本概念:催化剂和同素异形体等。因而只要把这些概念搞清楚,便很快选出正确答案。
本题正确选项为1.D、2.C
*[例5] 1956年李政道和杨振宁提出在弱相互作用中宇宙不守恒,并由吴健雄用 Co放射源进行了实验验证,次年,李、杨二人为此获得诺贝尔物理奖,
Co放射源进行了实验验证,次年,李、杨二人为此获得诺贝尔物理奖, Co衰变过程是:
Co衰变过程是:
 Co→
Co→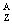 Ni+
Ni+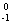 e+
e+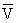 c
c
其中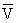 c 是反中微子,它的电荷为零,静止质量可认为是零。
c 是反中微子,它的电荷为零,静止质量可认为是零。
(1)Co与Fe同周期,它应在周期表的第____________周期, Co的核外电子数为____________,在上述衰变方程中,衰变产物
Co的核外电子数为____________,在上述衰变方程中,衰变产物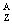 Ni的质量数A是____________,核电荷数Z是____________。
Ni的质量数A是____________,核电荷数Z是____________。
(2)在衰变前, Co核静止,根据云室照片可以看出,衰变产物
Co核静止,根据云室照片可以看出,衰变产物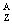 Ni和
Ni和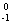 e的运动轨迹不在一条直线上,如果认为衰变产物只有Ni和
e的运动轨迹不在一条直线上,如果认为衰变产物只有Ni和 e,那么衰变过程将违背____________守恒定律。
e,那么衰变过程将违背____________守恒定律。
(3)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验中用作吸湿剂和空气湿度指示剂。
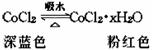
现有无水CoCl265g,吸水后变为CoCl2·xH2O119g,水合物中的x的值是____________。
(4) Co放出的γ射线,可用于作物诱变育种,我国应用该方法培育出了许多农作物新品种,如棉花高产品种“鲁棉1号”,年种植面积达到3000多万亩,在我国自己培育的棉花品种中栽培面积最大,γ射线处理作物后主要引起____________,从而产生可遗传的变异,除γ射线外,用于人工诱变的其它理化因素还有____________、____________、____________和____________。
Co放出的γ射线,可用于作物诱变育种,我国应用该方法培育出了许多农作物新品种,如棉花高产品种“鲁棉1号”,年种植面积达到3000多万亩,在我国自己培育的棉花品种中栽培面积最大,γ射线处理作物后主要引起____________,从而产生可遗传的变异,除γ射线外,用于人工诱变的其它理化因素还有____________、____________、____________和____________。
[解析]
本题以华裔科学家所获诺贝尔奖成果为背景命题,试题介绍了 Co衰变方程,围绕
Co衰变方程,围绕 Co进行了多角度、多层次的设问,涉及到化学上的元素周期律、水合物,物理上的原子核结构、动量守恒定律,生物学上的人工诱变、基因变化等知识,考查学生运用理化生知识综合分析事物的能力。第(1)问需要综合物理、化学知识来解决,第(2)、(3)、(4)问分别用理化生知识解决,
Co进行了多角度、多层次的设问,涉及到化学上的元素周期律、水合物,物理上的原子核结构、动量守恒定律,生物学上的人工诱变、基因变化等知识,考查学生运用理化生知识综合分析事物的能力。第(1)问需要综合物理、化学知识来解决,第(2)、(3)、(4)问分别用理化生知识解决,
[答案] (1)4,27,28 (2)动量 (3)6 (4)基因突变,X射线、硫酸二乙酯、亚硝酸、紫外线、激光。
2.绿色化学:核心是利用化学原理从源头上减少和消除工业生产对环境的影响。
原子利用率为期望产物的总质量与生成物的总质量之比。对于具体的化学反应,原子利用率等于期望生成物的摩尔质量与生成物的总摩尔质量之比。
原子利用率= 。
试题枚举
例1石油炼制过程中,既能提高汽油产量又能提高汽油质量的方法 是( )
A 常压分馏 B减压分馏 C 裂解 D 催化裂化
[解析]选项中的四种方法都是石油炼制加工的方法,其目的不一样,A项只能对石油进行初步加工,各类烃的质量仅占石油总量的25%左右。B项操作不会得到汽油,C项中所得产物主要是乙烯、丙烯等小分子短链化合物。只有D项能得到质量更高、产量更多的汽油。
答案: D
例2“绿色化学“要求从技术、经济上设计出可行的化学反应,尽可能减少对环境的副作用。下列化学反应中,你认为最不符合绿色化学概念的是( )
A.除硫酸厂尾气:SO2+2NH3+H2O=(NH4)2SO4
B.消除硝酸工业尾气氮氧化物的污染:NO+NO2+2NaOH=2NaNO2+H2O
C.制硫酸铜:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.制硫酸铜:2Cu+O2 2CuO;
CuO+H2SO4(稀)=CuSO4+H2O
2CuO;
CuO+H2SO4(稀)=CuSO4+H2O
解析:A 、B的化学反应是对有害气体的吸收,符合“绿色化学“的要求,C、D的目的是制硫酸铜,C中产生有毒的气体SO2 ,会造成大气污染,对比分析会发现D比C要节约原料,又不会产生有害气体。
答案: C
例3工业上从海水中提取单质溴,其中有一种工艺采用如下方法:
(1) 向海水中通入氯气将海水中的溴化物氧化,其离子方程式为:
(2) 向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,这时,溴就转化成溴离子和溴酸根离子,其化学方程式为: 。
(3) 将(2)所得溶液用H2SO4酸化,又可得到单质溴,再用有机溶液萃取溴后,还可以得到副产品Na2SO4 。这一过程可用化学方程式表示为: 。
(4) 这样得到的溴中还混有少量 Cl2,这样除去Cl2 ?写出反应的离子方程式:
。
解析:Cl2能将Br2从海水中置换出来,由于有:Br2+H2O=HBr+HBrO,大家往往会推测出Br2与纯碱反应生成的盐是NaBr和NaBrO。这样推测是没有注意审题,题中说Br2“转化成溴离子和溴酸根离子”,所以生成的盐是NaBr和NaBrO3。NaBr和NaBrO3的混合溶液用硫酸酸化,又可得到单质溴,显然是发生了价态归中的氧化还原反应。
答案:(1)Cl2+2Br-=Br2+2Cl-
(2)3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑
(3)5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
(4) Cl2+2Br-=Br2+2Cl-
1.环境污染:包括 , , 和食品污染。
2.海水化学资源的利用:(1)海盐的生产:海水制盐具有悠久的历史,从海水中制取 , ,是在传统海水制盐工业上的发展。(2)Cl、Br、I的提取
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com