
15. 工业制硫酸生产流程如下图:
|
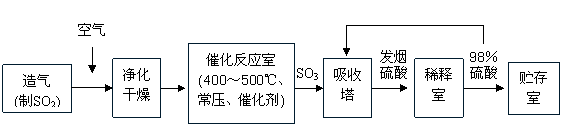

(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充空气 D.及时分离出SO3
 (2)在生产中,为提高催化剂效率采取了哪些措施?
(2)在生产中,为提高催化剂效率采取了哪些措施?
A.净化气体 B.控制温度在400-500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(5)生产硫酸过程中的尾气通常用氨水吸收,请写出该反应的化学反应方程式 。
答案 (1)C、D
(2)ABC
(3)① < 在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热量小于196kJ
(4)93.4%
(5)2NH3·H2O+SO3= (NH4)2SO4+ H2O 2NH3·H2O+SO2=(NH4)2SO3 + H2O
14. (哈尔滨市第九中学2008-2009学年度高三第三次月考 )(8分)用如图所示装置进行实验探究某物质的生产过程.回答有关问题:
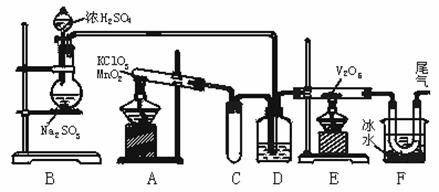
(1)玻璃管E内发生反应的化学方程式:_____________ ______________ _ ___.
(2)小试管C的作用是___________________________________________ _____.
(3)广口瓶D内盛的试剂是__________________________ __.
(4)从E装置导出的气体成分是_______________ ___.
(5)装置F中U型管所收集的物质的颜色、状态是_______________ _______.
答案.(1)2SO2 + O2 ==2SO3(可逆、加热、催化剂)
(2)防止倒吸
(3)浓硫酸
(4)SO2 O2 SO3
(5)无色固体
13. (安徽宿州市2009届高三10月考)Ⅰ.将3.2g Cu与足量的浓硫酸在加热条件下充分反应。
(1)此反应的化学方程式为________________ ,
其中被还原的硫酸的物质的量为________________。
 (2)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的
(2)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的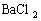 溶液,得到沉淀23.3g,则稀释后所得溶液中
溶液,得到沉淀23.3g,则稀释后所得溶液中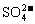 的物质的量浓度为________________。
的物质的量浓度为________________。
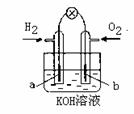
Ⅱ. 若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是 极(填“正”或“负”)。b极的电极反应式为 。
Ⅲ.某些化学反应可用下式表示
A + B ─→ C + D + H2O
请回答下列问题:
(1)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(2)若A为红色的金属单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
答案
Ⅰ.(1)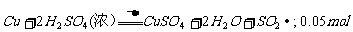
(2)2mol/L
 Ⅱ.负 O2+2H2O+4e-=4OH-
Ⅱ.负 O2+2H2O+4e-=4OH-
Ⅲ. (1)C、浓H2SO4
(2)Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O
(或:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O)
(3)Na2SO4、O2
12.(09重庆市五区高三联考)将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
 (2)溶液稀释后,c(H+)是多少?
(2)溶液稀释后,c(H+)是多少?
答案 有关化学方程式:
① CuO + H2SO4 === CuSO4 + H2O
②
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
设混合物中Cu的物质的量为x,CuO的物质的量为y。
有: 64x + 80y =20.8…………………………①
x + y =0.3………………………………②
解得:x=0.2mol y=0.1mol
(1)V(SO2)=0.2mol×22.4L/mol = 4.48L
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol
n(H2SO4)反应=2x + y=0.5mol
n(H2SO4)余=0.92mol-0.5mol=0.42mol
故 c(H +)=0.42mol×2÷1L=0.84mol/L
11. (安徽2009届高三10月考) 5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式: 。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是

(3)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是

A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
答案 (1)2ClO3-+SO2=2ClO2+SO42- (2)0.8NA (3)B
10. 根据下列事实得出的结论正确的是 ( )

A. Na2SO3试样 白色沉淀 沉淀不溶液;
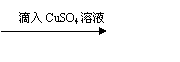 结论:此Na2SO3试样已变质
结论:此Na2SO3试样已变质
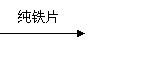
B.稀硫酸 产生量少气泡 产生大量气泡;
 结论:CuSO4对此反应有催化作用
结论:CuSO4对此反应有催化作用
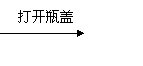
C.某溶液 冒着白雾
结论:此溶液为浓盐酸
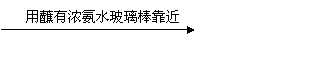
D.无色试液 呈黄色;结论:此溶液一定含有Na+
答案:D
9. 含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是 ( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
答案 A
8.硫酸铜遇到黄铁矿(FeS2)可以发生反应:
14CuSO4 + 5FeS2 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4 ,
在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为:
 A. 7∶3
B. 3∶7 C.7∶5 D.5∶7
A. 7∶3
B. 3∶7 C.7∶5 D.5∶7
答案:B
7.(衡水中学2008-2009学年度上学期三调考试)进行化学实验时必须注意实验安全。下列实验操作合理的是 ( )
A.为防止试管破裂加热固体高锰酸钾制氧气时,试管口应略向下倾斜
B.进行SO2性质探究实验时,多余的SO2应排到实验室外
C.为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒入垃圾箱
D.配制H2SO4溶液时,先在量筒中加一定体积的水,然后边搅拦边慢慢加入浓H2SO4
答案:A
6.(衡水中学2008-2009学年度上学期三调考试)标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是 ( )
A H2S、SO2 B O2 C H2S D SO3
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com