
4.晶体类型的分类及判断方法
可据元素组成来判断:金属单质为金属晶体;金刚石、晶体硅、二氧化硅、碳化硅等为原子晶体;含金属阳离子或铵根离子的化合物为离子晶体;其他由非金属元素组成的单质和化合物为分子晶体。
3.电子式的书写方法
⑴要区别“用电子式表示物质的形成过程”和“用电子式表示物质”的提法不同,表示也应不同。
⑵注意离子化合物与共价化合物表示上的区别,如是否用[]及“+”“-”等。
⑶注意一些较复杂化合物电子式的正确书写。如Na2O2、H2O、HClO、Al2O3、Mg3N2、(NH4)2S、Ba(OH)2等。
2.分子极性的判断:⑴单质分子一般为非极性分子;⑵化合物①AB型分子全为极性分子, ② ABn型分子:若A的化合价等于其价电子数目,则分子的空间结构对称,其分子为非极性分子;若A的化合价不等于其价电子数目,则分子的空间结构不对称,其分子为极性分子。
1.化学键包括离子键、共价键和金属键,应从原子结构的特征出发分析单质和化合物的粒子(分子、离子、原子)间的强烈相互作用所形成的化学键,切实掌握化学键的概念、分类、实质与特征,了解键的极性;并注意与分子间作用力和氢键的区别。
16.⑴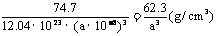
⑵n(Ni3+):n(Ni2+)=6:91
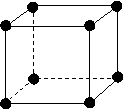
讲析:⑴如图所示,以立方体作为计算单元,此结构中含有Ni2+-O2-离子数为:4×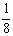 =
=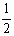 (个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷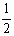 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
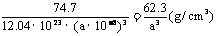
⑵解法一(列方程):设1molNi0.97O中含Ni3+为xmol,Ni2+为ymol,则得
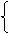 x+y=0.97 (Ni原子个数守恒)
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06,y=0.91,故n(Ni3+):n(Ni2+)=6:91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
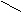
 Ni3+ 3
0.06/0.97
Ni3+ 3
0.06/0.97
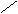
 2/0.97
2/0.97
Ni2+ 2 0.91/0.97
故n(Ni3+):n(Ni2+)=6:91。

15.(1)C 第二周期第ⅣA族 (2)CCl4 正四面体 109°28’ (3)CO2 直线型 180° (4)灭火剂和有机溶剂
14.(1)H O Na S (2)SO3 H2O2 Na2O2 (3)NaHSO3 NaHSO4
13.⑴ ⑵ NaOH 〉Mg(OH)2
⑵ NaOH 〉Mg(OH)2
⑶ NH3 + H2O
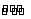 NH3·H2O
NH3·H2O 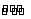 NH4+
+ OH-
NH4+
+ OH-
⑷ 分子晶体 ⑸ OH- ;H2O
1.D 2.AD 3.C 4.C 5.B 6.A 7.C 8.D 9.B 10.CD 11.C 12.C
讲析:1.电解质电离时共价键被破坏。 2.可根据元素的化合价来判断氧化物是否是酸酐。 3.本题重点抓住正离子N5+整体为+1价来分析。 5.据题给性质推断氮化硅为原子晶体。 6.根据构成晶体的粒子种类以及它们之间的相互作用的强弱不同来判断。 7.根据玻璃态的水不存在晶体结构,密度不变来判断。 9.由于晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,由此得出8个笼中共有6个CH4
分子,46+2=48个H2O分子。 11.本题可根据排除法来判断,注意氢键存在于分子间,且气体物质分子之间无相互作用,不存在氢键。 12.n(Ca):n(Ti):n(O)=1:(8╳1/8):(12╳1/4)
3.⑴假定两刚性球间彼此相切,这才可将Li+与I-的距离看成是两离子半径之和。⑵ 0.214nm 0.088nm ⑶r+>0.060nm-0.068nm,说明将Li+和I-看成刚性球组实际不相切。因为电子之间相互排斥,致使两离子半径之和小于它们之间的理论距离。
讲析:⑵根据NaCl的晶体结构即可建立如上图所示的“数学模型”。设图中大圆表示I-,其半径为r-,小圆为Li+,其半径为r+,则有如下关系:AC=2(r++r-),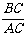 =sin45°,BC=2r-,根据上式解得r+/r-=0.414,又由假定知:r++r-=0.303nm,从而解得r+=0.088nm,r-=0.214nm
=sin45°,BC=2r-,根据上式解得r+/r-=0.414,又由假定知:r++r-=0.303nm,从而解得r+=0.088nm,r-=0.214nm
检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com