
1.合成氨适宜条件的选择
温度:500℃左右 压强:20MPa-50MPa为宜
催化剂:铁触媒
浓度:增大N2、H2的浓度、减小NH3的浓度
13.(1)恒温时,密闭容器中通入2molA(g)和1molB(g) 发生反应达平衡,压强一定时C的体积分数为0.4。若与上述平衡保持同温、同压,且n (A):n (B)=2:1,则为等效平衡,C的体积分数仍为0.4。
2A(g)+B(g)  2C(g)
2C(g)
起始物质的量(mol) 4 2 0
平衡物质的量(mol) 4-2x 2-x 2x
则有2x/(4-2x+2-x+2x)×100%=0.4 x=1
n(总)= 4-2x+2-x+2x=6-x=5
(2) 2A(g) +
B(g)  2C(g)
2C(g)
起始物质的量(mol) n(A) n(B) 0
平衡物质的量(mol) n(A)-2y n(B)-y 2y
据题意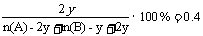
有:n(A)+n(B)=6y……①
且n(A)-2y>0…… ②
n(B)-y>0…… ③
联立①②③解得:0.5n(B)<n(A)<5n(B)
则a=0.5, b=5
12.
(1)n(P4 )=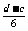 mol n(PH3
)=
mol n(PH3
)=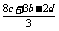 mol
(2)a>b+2c;
mol
(2)a>b+2c; 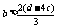
11.(1)③⑤④①②
(2)增大C(H+),使两个平衡向左移动,防止生成Na2CrO4
(3)因为Na2SO4的溶解度随温度升高而减小,所以应趁
热滤出Na2SO4晶体。
10.(1)D (2)降低;增大;<;增大体积使二氧化碳压强减小,平衡向右移动,由于正反应是吸热的,故使体系温度降低。在低于850℃的温度下,重新达平衡时,二氧化碳的压强必小于850℃的平衡压强4.94×104Pa。
讲析:(1)升温与加压,对平衡移动方向效果相反,故无法确定。
(2)根据图表数据,升高温度增大的倍数比气体压强增大的倍数要小,生成了更多的气体,可判断平衡向右反应方向为吸热反应,现减压平衡右移,故温度降低,压强变小。
9.B.石脑油,因为石脑油和水生成的H2与CO2物质的量之比为3.2:1,与合成氨、合成尿素中该比值最接近,原料利用最充分。
讲析:由2NH3-CO2,导出原料利用率的最佳关系:3 H2-CO2,故只有当n(H2):n(CO2)接近3:1时,各原料的利用率最高。现对上述物质写出有关的反应方程式并导出各自对应的n(H2):n(CO2)
A.CO+ H2O H2+ CO2 1:1,氢气不足,CO2不能充分利用。
H2+ CO2 1:1,氢气不足,CO2不能充分利用。
B.C5H12+10H2O 16 H2+5CO2 3.2:1,接近最佳比。
16 H2+5CO2 3.2:1,接近最佳比。
C6H14+12
H2O 19H2十6CO2 3.2:1,接近最佳比。
19H2十6CO2 3.2:1,接近最佳比。
C.CH4十2H2O 4H2+ CO2 4:1,氢气过量,利用率低。
4H2+ CO2 4:1,氢气过量,利用率低。
D.C十2H2O 2H2+ CO2 2:1,氢气不足,CO2利用率低。
2H2+ CO2 2:1,氢气不足,CO2利用率低。
注意:工业生产中,一般按化学方程式中反应物的化学计量数比投入原料,可使原料都得到充分利用,如合成氨中是按体积比N2:H2=1:3投料。只有对于某些易得的价格相差较大的原料参加的可逆反应,才考虑将廉价原料过量投入,促使平衡向正反应方向移动,提高另一种价格高的原料的利用率。
8.设起始时通入的一定量A气体为n mol
2A(g)  B(g) + xC(g)
B(g) + xC(g)
起始(mol) n 0 0
变化(mol) na% 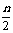 a%
a% 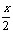 na%
na%
平衡(mol)n(1-a%) 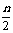 a%
a% 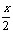 na%
na%
据气体定律有:n/[n(1-a%)+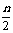 a% +
a% +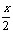 na%]=1/[1+p%]
na%]=1/[1+p%]
解得:(x-1)a=2p 对照选项可知BC符合。
1.B 2.C 3.B 4.B 5.A 6.A 7.BC 8.BC
讲析:2.由于NO2气体中总是存在2NO2(g)
 N2O4(g);△H<0 这一反应,故通常测得的“NO2的相对分子质量”,往往是NO2与N2O4的平均相对分子质量,故测量值总是偏高。为了尽可能准确地测定NO2的相对分子质量,应使可逆反应尽量向逆反应方向移动。根据化学平衡移动原理,升高温度,减小压强都使平衡向逆反应方向移动。4.增大压强正逆反应速率都增大,则反应物和生成物中一定都有气体。且
N2O4(g);△H<0 这一反应,故通常测得的“NO2的相对分子质量”,往往是NO2与N2O4的平均相对分子质量,故测量值总是偏高。为了尽可能准确地测定NO2的相对分子质量,应使可逆反应尽量向逆反应方向移动。根据化学平衡移动原理,升高温度,减小压强都使平衡向逆反应方向移动。4.增大压强正逆反应速率都增大,则反应物和生成物中一定都有气体。且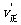 >
>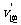 ,说明正反应是气体体积缩小的反应。 6.运用差量法求解。 7.化学平衡的计算模式: mA2(g)+nB2(g)
,说明正反应是气体体积缩小的反应。 6.运用差量法求解。 7.化学平衡的计算模式: mA2(g)+nB2(g) pC(g)
pC(g)
起始浓度(mol/L) a a 0
变化浓度(mol/L) mx nx px
平衡浓度(mol/L) a-mx a-nx px
据题意:a-mx=0.9 a-nx=0.1 px=0.8
联立解得:n-m=p 对照选项,运用原子守恒,满足关系的是BC。
4.(1)减小,通入适量SO2或给体系升温 (2)任意值 (3)3.6<c≤4
讲析:(2)a:b=1.2:0.6=2:1,与反应达到平衡状态A时的起始比例相同,为恒温恒压下的等效平衡,生成物只有一种物质,则c取任意值。
(3)
2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
起始量 a b c
据题意有: a+b+c<4.2……①
假设c molSO3完全转化为SO2、O2,则
(a+c)+(b+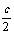 )=6……② 联立①②得:c>3.6
)=6……② 联立①②得:c>3.6
若起始时只有SO3,则c≤4。
c的取值范围:3.6<c≤4
检测提高
3.(1)770℃ 890℃
(2)降低压强或移去钾蒸气 适当升高温度
(3)K=C(K)/C(Na)
讲析:此题要求学生能够分析图表数据,并结合化学平衡移动原理加以运用。要知道常压为101.3Kpa,且对平衡常数数学表达式的要求要熟悉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com