
19.(1)H++Ac-=HAc HAc+OH-= Ac-+H2O
(2)H2CO3 NaHCO3 ,H3PO4 NaH2PO4
18.(1)C (2)E (3)A (4)D ;1 (5)E
17.(1)HCO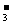 +Br2=HBrO+Br-+CO2
(2)2CO
+Br2=HBrO+Br-+CO2
(2)2CO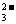 +Br2+H2O=BrO-+Br-+2HCO
+Br2+H2O=BrO-+Br-+2HCO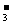
16. (1) 溶液变黄;加入OH-后,使[H+]下降,水解平衡向正反应方向移动;
(2) 溶液变成原来的颜色; H2SO4完全中和所加的NaOH,平衡恢复原状况;
(3) 溶液变成橙色; c(H+)增大,平衡向左移动,使c(Cr2O72-)增大
1.D 2.B 3.D 4.AD 5.A 6.B 7.D 8. B 9.CD 10.D 11.D 12.AC 13.BD 14.A 15.AC
4.Ba2++C2O42- BaC2O4
BaC2O4+2H+=Ba2++H2C2O4,Ba2C2O4在溶液中存在如下溶解平衡:BaC2O4(S) =Ba2++C2O42-,加入盐酸,H+与C2O42-反应生成弱电解质H2C2O4,使溶解平衡向右移动,沉淀溶解;
较强的酸与较弱的酸的盐反应生成较弱的酸。
检测提高
3.方法一:在醋酸溶液中滴入石蕊试液,溶液呈红色,加入醋酸铵固体,振荡溶液,溶液颜色明显变浅。C(H+)变小,是由于加入的CH3COO-使平衡向左移动,由此说明醋酸溶液存在醋酸的电离平衡。方法二:取一定体积的溶液,用pH试纸测其溶液的pH,然后再用蒸馏水将溶液稀释100倍,再测定溶液的pH,若稀释前后溶液的pH改变小于2,说明存在上述的电离平衡。
讲析:CH3COOH是弱电解质,溶于水后部分电离,溶液中存在电离平衡,如条件改变,电离平衡会发生移动,溶液中各种离子的浓度都会发生改变。再实验中,可通过验证氢离子的浓度的改变来证明醋酸再溶液中存在电离平衡。由于题目没有给定试剂和限定方法,故思考的空间比较大。
2.
|
|
初速率 |
氢气物质的量 |
|
(1)同体积同物质的量浓度 |
c>a>b |
c>a=b |
|
(2)同体积同pH值 |
c=a=b |
b>a=c |
1.①②⑧; ③④⑨;⑤;⑥⑦⑩
14. ⑴在“O”点处醋酸未电离,无离子存在 。⑵c<a<b 。 ⑶c ⑷C、E、F
第14课时 (B卷)
纠错训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com