
4.现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH值=11的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组
溶液pH值的大小:
(Ⅰ)组_______ _ ,
(Ⅱ)组_________ __。
(本题考查强酸(碱)、弱酸(碱)加水稀释时溶液的pH值变化情况,属于理解层次。可尝试运用图示法分析)
新活题网站
3.已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是 ( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸的碱盐
(本题考查了酸碱混合反应,注重逻辑推理及思维的全面性,体现综合能力。注意pH的计算结合盐类水解的有关知识)
2.(全国高考题)在80℃时,纯水的pH值小于7,其原因是
。
(本题主要考查水的电离、pH值与水的离子积Kw之间的关系,以及Kw与温度的关系,涉及的概念较多,需仔细、深入地思考分析,理清各种关系才好作答。由于本题是简答题型,也考查文字表达能力)
1.(2001年上海高考)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念 则下列叙述正确的是
( )
则下列叙述正确的是
( )
A 中性溶液的AG=0 B 酸性溶液的AG<0
C 常温下0.lmol/L氢氧化钠溶液的AG=12
D 常温下0.lmol/L盐酸溶液的AG=12
(该题是信息题,考查了学生利用已有溶液的酸碱性的知识处理信息题的能力,溶液酸性越强,酸度越大,把握好信息的涵义。)
4.酸混合、碱混合、酸碱混合pH计算:
酸算c(H+),碱先算c(OH-)后再转化为c(H+),再求pH,酸碱混合(一者过量)
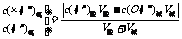
典型题点击
3. 溶液的酸碱性和pH的关系
⑴ pH的计算:pH=-lg c(H+)
⑵ 酸碱性和pH的关系:
室温中性溶液C(H+)=C(OH-)=10-7mol∕L,pH=7
酸性溶液:c(H+)>c(OH-),c(H+)>1×10-7 mol∕L,pH<7
碱性溶液:c(H+)<c(OH-),c(H+)<1×10-7 mol∕L,pH>7
⑶pH的测定方法:①pH试纸;②酸碱指示剂、pH计等。
2. 掌握影响水的电离平衡的因素
⑴酸和碱:酸或碱加入都会电离出H+或OH-,均使水的电离左移,从而抑制水的电离。
⑵温度:若升温,由于水电离吸热,升温将促进水的电离,平衡右移,c(H+)与c(OH-)同时同等程度增加,pH变小,但c(H+)与c(OH-)始终相等,故仍显中性。
⑶能水解的盐:不管水解后溶液呈什么性,促进水的电离,使水的电离程度增大。
⑷其他因素:如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离平衡向电离的方向移动。
1. 理解水的电离和离子积的概念。
 ⑴水的电离平衡:水是极弱的电解质,水的电离方程式 H2O+H2O H3O++OH-(正反应为吸热反应),其电离常数:K= c(H+)·c(OH-)/c(H2O)。
⑴水的电离平衡:水是极弱的电解质,水的电离方程式 H2O+H2O H3O++OH-(正反应为吸热反应),其电离常数:K= c(H+)·c(OH-)/c(H2O)。
⑵水的离子积常数:Kw=c(H+)×c(OH-)例:25℃时水的Kw=10-14,水的离子积常数与温度有关,温度升高,Kw增大。
⑶无论纯水还是酸、碱、盐的稀溶液,水的离子积常数为该温度下的Kw。
20.将0.05mol/L的盐酸溶液和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得混合溶液的c(OH-)=0.01mol/L.用上述氢氧化钠滴定20mLc(H+)=0.001mol/L的某一元弱酸溶液,达到终点消耗12.5mL氢氧化钠溶液.试求:
(1) 氢氧化钠溶液的物质的量浓度
(2) 此一元弱酸的物质的量浓度
19. 弱酸和它们的盐或弱碱和它们的盐组成的混合物的溶液称为缓冲溶液. 缓冲溶液具有抵抗外来少量酸或碱的干扰, 使溶液的 PH 值基本保持不变(缓冲作用), 人们血液中的缓冲作用的缓冲对是 H2CO3 (弱酸)和 HCO3-(弱酸盐),缓冲作用的原理可表示为: HCO3- + H+ = H2CO3
H2CO3 + OH- = HCO3- + H2O
(1) 含有一定量HAc 和 NaAc 的水溶液也具有缓冲作用, 写出在此过程中加入酸或碱的离子反应方程式为:
加入酸_________________________;
加入碱
(2) 请写出另外可以形成缓冲溶液的两组物质:
, 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com