
2.再室温下.某溶液中由水电离的H+浓度为1.0×10-13mol/L-1,则此溶液中一定不可能大量存在的离子组是( )
A.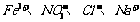
B.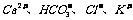
C.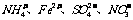
D.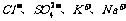
1.(2000年全国高考)室温下,在pH=12的某溶液中,由水电离的c(OH-)为 ( )
A.1.0×10-7mol·L-1 B.1.0×10-6mol·L-1
C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
4.常温下,再电解质溶液中,若水电离的H+浓度小于1×10-7mol/L学生常不能考虑到可能是酸或碱溶液,若水电离的H+浓度大于1×10-7mol/L一定盐类的水解。
纠错训练
3.在溶液混合过程中的pH计算,学生对碱和碱的混合求pH时,常把握不好,会忽略了水电离产生的c(H+)而导致错误,应先求c(OH-)混再求c(H+)混,最后求pH
2.判断溶液的酸碱性仅根据pH而不抓住关键-即比较c(H+)与c(OH-)的大小。
1.酸、碱溶液无限稀释时,学生由于不去考虑水电离出的
c(H+)和c(OH-)出现了酸稀释的pH大于7(碱的pH小于7)的现象。
14.某工厂每天排废水1000m3,其中含游离氯0.0005mol/L,且PH = 3。现分两步处理废水,先用Na2SO3还原游离氯,再用熟石灰中和。
(1)计算该厂每天需要98%的Na2SO3的质量。
(2)用Na2SO3处理后的废水的PH值是多少?
(3)为使废水呈中性,需含杂质10%的熟石灰的质量是多少?
(本题是关于氧化还原反应的计算,涉及pH的计算)
第15课时 水的电离和溶液的pH(B卷)
易错现象
13.常温下,有PH值为12的NaOH溶液100mL,若将其PH值变为11(设溶液的体积可以直接相加,计算结果保留到小数点后一位)。
(1) 若用PH=10的NaOH溶液,应加入__________mL
(2) 若用PH=2的盐酸,应加入_______mL
(3) 若用0.01mol·L-1的CH3COOH溶液V1mL,则V1的取值为________
(4) 若用PH=2的任意一元酸溶液V2 mL ,则V2的取值为_____________。
(本题考查学生的pH计算能力)
12.在下列情况下, 离子组间一定能在溶液中同时大量共存的是: ( )
A. 水电离出的 [H+] = 10-14 mol/L 的溶液中: Na+、HCO3-、Cl-、SO42-
B. H试纸呈现红色的溶液: Fe2+、K+、NO3-、Na+
C. CO32-可以大量共存的溶液: Ag+、K+、NO3-、Al3+
D. PH = 2 的溶液中: SO42-、K+、NO3-、Al3+
(本题考查溶液中离子同时大量共存的问题,要结合水的电离和溶液的pH的计算)
11.pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,充分反应后,收集H2的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是 ( )
A、HX一定是弱酸 B、HY一定是强酸
C、HX的酸性强于HY的酸性 D、反应开始时二者生成H2的速率相同
(本题主要考查学生对pH的计算以及反应速率与浓度的关系的掌握)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com