
1.CD 2.D 3.AC
讲析:1.pH=12的溶液,可能是碱溶液,也可能是盐溶液。忽略了强碱弱酸盐的水解,就会漏选D. 2.由水电离的H+浓度为1.0×10-13mol/L-1的溶液可能是酸或者碱溶液。3.HCl溶于水完全电离,而CH3COOH溶于水存在电离平衡:CH3COOH=CH3COO-+H+,加水该平衡向右移动,H+物质的量增大,需加更多的水才能与盐酸c(H+)相同;加CH3COONa时,c(CH3COO-)增大,上述平衡向左移动。c(H+)降低,pH变化大,而盐酸加NaCl后pH基本不变。故A、C符合题意。B只能说明盐酸和醋酸具有挥发性,D只说明c(H+)相同,速率相同,与醋酸是否完全电离均无关,故B、D不符题意。
14.(1)62.3kg (2)2.7 (3)82.2kg
第15课时 (B卷)
纠错训练
13.1000 mL,81.8 mL ,大于81.8 mL , 0<V2≤81.8
9.CD 10.C 11.AD 12.D
讲析:5.因为pH相同的强酸和弱酸等倍稀释时,弱酸的pH小,所以如果稀释后的pH要相同,弱酸的稀释倍数要大,所以a>b 7.强酸中c(H+)=10-amol·L-1,强碱中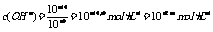 1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)
1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)
1.D 2.C 3.D 4. CD 5.D 6.B 7.B 8.B
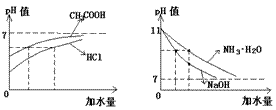
4.(Ⅰ)组CH3COOH>HCl,(Ⅱ)组NH3·H2O>NaOH。
讲析:用图示分析如下。
新活题网站
1.AD 2.B 3.B
讲析:1.中性溶液中,  ,AG=0;酸性溶液中,
,AG=0;酸性溶液中,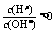 ,AG<1,AG<0。常温下0.1mol·L-1氢氧化钠溶液中,
,AG<1,AG<0。常温下0.1mol·L-1氢氧化钠溶液中,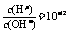 ,AG=-12;常温下0.1mol·L-1盐酸溶液中,
,AG=-12;常温下0.1mol·L-1盐酸溶液中,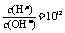 ,AG=12。 2.纯水的pH值是由其[H+]决定的。[H+]对水的离子积Kw有关,而Kw在不同温度时数值不一样,常温(25℃)时水的Kw=1×10-14,纯水中[H+]=[OH-]=10-7mol/L。因水的电离是吸热反应,温度升高到80℃,平衡向右移动,电离程度加大,Kw>1×10-14,[H+]=[OH-]>1×10-7mol/L,所以pH<7。由于是纯水[H+]=[OH-],纯水仍是中性,不是酸性,任何温度下纯水都是中性。答案:因水的电离是吸热反应,温度升高到80℃,平衡向右移动,电离程度加大,Kw>1×10-14,[H+]=[OH-]>1×10-7mol/L,所以pH<7 3.本题的特点是:由实验结果分析,酸和碱溶液混合后所得溶液呈酸性,原因有两种可能:一是这两种溶液恰好完全反应,但参与反应的是弱碱和强酸,生成强酸弱碱盐,易水解而显酸性;二是酸和碱并没有恰好完全反应,反应后酸有剩余,因而溶液显酸性。本题中的酸溶液[H+]=1×10-3mol/L,如此应是强酸,它是完全电离,可见它是一种稀溶液;如是弱酸,因它只有少部分电离,则弱酸的浓度可能较大。碱溶液[OH-]=1×10-3mol/L,当然也适于上述分析,即或是强碱的稀溶液,或是弱碱的较浓溶液,根据选项,依照题意,可确定(B)为正确选项。
,AG=12。 2.纯水的pH值是由其[H+]决定的。[H+]对水的离子积Kw有关,而Kw在不同温度时数值不一样,常温(25℃)时水的Kw=1×10-14,纯水中[H+]=[OH-]=10-7mol/L。因水的电离是吸热反应,温度升高到80℃,平衡向右移动,电离程度加大,Kw>1×10-14,[H+]=[OH-]>1×10-7mol/L,所以pH<7。由于是纯水[H+]=[OH-],纯水仍是中性,不是酸性,任何温度下纯水都是中性。答案:因水的电离是吸热反应,温度升高到80℃,平衡向右移动,电离程度加大,Kw>1×10-14,[H+]=[OH-]>1×10-7mol/L,所以pH<7 3.本题的特点是:由实验结果分析,酸和碱溶液混合后所得溶液呈酸性,原因有两种可能:一是这两种溶液恰好完全反应,但参与反应的是弱碱和强酸,生成强酸弱碱盐,易水解而显酸性;二是酸和碱并没有恰好完全反应,反应后酸有剩余,因而溶液显酸性。本题中的酸溶液[H+]=1×10-3mol/L,如此应是强酸,它是完全电离,可见它是一种稀溶液;如是弱酸,因它只有少部分电离,则弱酸的浓度可能较大。碱溶液[OH-]=1×10-3mol/L,当然也适于上述分析,即或是强碱的稀溶液,或是弱碱的较浓溶液,根据选项,依照题意,可确定(B)为正确选项。
4.难溶化合物的饱和溶液存在着溶解平衡,例如:
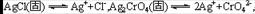 在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10
Ksp(Ag2CrO4)={c(Ag+)}2c(CrO42-)=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5摩/升时,则认为可以达到有效分离)
在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10
Ksp(Ag2CrO4)={c(Ag+)}2c(CrO42-)=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5摩/升时,则认为可以达到有效分离)
23. 已知氢氧化钠和氢氧化钡混合溶液的pH = 14, 现取 100毫升该混合溶液, 缓缓通入CO2, 当通入的 CO2 气体体积为 0.56升时, 生成的沉淀已达最多(设CO2 被完全吸收, 气体的体积均为标准状况下测定, 溶液的体积变化忽略不计), 则:
(1) 原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少?
(2) 当通入的CO2 总体积为 2.24升时, 溶液中各离子(除H+ 和 OH-)的物质的量的浓度为多少?
22.在25℃时,有pH=a的盐酸与pH=b的NaOH溶液,取VaL该盐酸同该NaOH溶液恰好反应,需VbLNaOH溶液,问:
(1)若a+b=14时,则Va/Vb= (填数值);
(2)若a+b=13时,则Va/Vb= (填数值);
(3)若a+b>14时,则Va/Vb= (填表达式),且Va Vb(填>、<或=)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com