
23.(1)0.025mol/L (2)c(Ba2+)=0.025mol/L
c(Na+)=0.05
mol/L c(HCO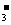 )=1mol/L
)=1mol/L
22.(1)1 (2)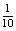 (3)10x+y-14,>
(3)10x+y-14,>
21.a+b= 13 讲析:因混和溶液呈中性,则原强酸溶液中H+数与原强碱溶液中OH-数相等,由此1 ⅹ10-a=10ⅹ10-14+b,对上述等式两边取对数,即lg(1 ⅹ10-a )= lg(10ⅹ10-14+b) 得a+b= 13。
20.3-5 讲析:“某酸” 若为为强酸溶液,则稀释100倍后,PH值增大2个单位,即为5;若为弱酸,则稀释后的[H+]=10-3ⅹ10-2ⅹα1/α2,PH=5-lg(α1/α2),因α1<α2,故PH=5-lg(α1/α2)<5
19.2.9ⅹ10-3g 讲析:设溶液为1L,由PH值可知1L溶液中所溶解的Mg(OH)2的质量,进而根据溶解度的概念,求得100g水中所溶解Mg(OH)2的质量。
18.各取等体积碱液少许,加水稀释相同倍数(如100倍),然后用pH试纸检验,pH变化大的为强碱溶液。
讲析:利用加水稀释过程中,强电解质和弱电解质溶液中离子浓度的变化程度不同这一特点可解决问题。稀释过程中,因弱电解质继续电离,所以在稀释相同倍数时,强电解质溶液中离子浓度的减小程度明显大于弱电解质。
16.C 17. AD
讲析:16.由于Ba(OH)2溶液的PH值为13,可求得它的物质的量的浓度为0.05mol/L,所以它的物质的量=0.05×0.06=0.003mol,从Ba(OH)2与磷酸的反应关系式3Ba(OH)2-2H3PO4可知,要使它与磷酸反应成中性,共需磷酸的物质的量为0.002mol,当PH值为P时,从图中可以看出消耗的磷酸的物质的量为总量的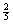 ,却0.002×
,却0.002×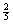 =0.0008mol,生成Ba3(PO4)20.0004mol,质量为0.24g。
=0.0008mol,生成Ba3(PO4)20.0004mol,质量为0.24g。
9.C 10.C 11.B 12.D 13.D 14.D 15.A
1.CD 2.AC 3.B 4.D 5.D 6.C 7.C 8.AD
4.(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否,若a=5,[H+]a=10-5mol·L-1,则b=10,[OH-]b = 10-4mol·L‑1
,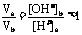 ,不符合题意,故a≠5
,不符合题意,故a≠5
(3)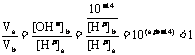
所以(a+b-14)<0,而a=0.5b
即3a<14,a<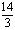
又pH=b=3a>7,a>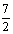 所以
所以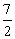 <a<
<a<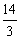
检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com