
13.某酸的酸式盐NaHY在水溶液中,HY-的电离度小于HY-的水解程度。有关叙述中正确的是( )
A.H2Y在电离时为:H2Y+H2O HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:
c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:
c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D.HY-水解方程式为:HY-+H2O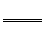 Y2-+H3O+
Y2-+H3O+
11.把100毫升、2摩/升的NaOH溶液,100毫升、2摩/升的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是 ( ) A.[SO42-]=[Na+]>[NH4+]>[OH-]>[H+] B.[Na+]>[SO42-]>[NH4+]>[OH-]>[H+]
C.[NH4+]>[SO42-]=[Na+]>[OH-]>[H+] D.[H+]+[NH4+]+[Na+] = [OH-]+2[SO42-] 12.有一种IA族金属的酸式盐AHB和H2B溶液,在相同条件下,AHB溶液中HB-的电离程度小于HB-的水解程度。下列说法正确的是 ( ) A.AHB的溶液呈弱酸性 B.室温下,同浓度的AOH和H2B溶液,电度度前者小于后者
C.该盐的电离方程式为AHB A++H++B2-
A++H++B2-
D.溶液各离子的摩尔浓度大小顺序为:
[A+]>[HB-]>[OH-]>[H+]
10.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
A.c(A-)≥c(M+)
B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+)
D.若MA水解,则c(OH-)>c(H+)
9.下列盐溶液因水解而显酸性的是( )
A.Na2S B.NaHCO3 C.Na2HPO4 D.NH4Cl
8.用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是 ( )
A.c(H+)>c(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.2 mol/L
7.在0.1摩/升的乙酸钠溶液中,下列离子浓度关系不正确的是 ( )
a+)=c(CH3COO-)+c(CH3COOH)
a+)+c(OH-)=c(CH3COO-)+2c(CH3COOH)+
c(H+)
a+)>c(CH3COO-) >c(OH-)>c(CH3COOH)>
c(H+)
a+)>c(OH-)=c(CH3COOH)>c(CH3COO-)>
c(H+)
6.镁粉放入NH4Cl溶液中能放出H2、NH3,产生这种现象的原因是 ( )
A.是金属镁把NH3置换出来
B.是镁具有强还原性,NH4+具有氧化性,发生氧化还原反应
C.是因为NH4+水解显酸性,Mg与H+反应放出H2,平衡右移
D.是因为Mg与水反应,生成的Mg(OH)2与NH4Cl反应
5.用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮用水处理的一种新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是 ( )
A. Na2FeO4在溶液中显强酸性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+水解为 Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物Fe2+水解为Pe(OH)2胶体,可使水中悬浮物凝聚沉降
4.下列物质的溶液中所含离子种类最多的是 ( )
A.Na2S B.Na3PO4 C.Na2CO3 D.AlCl3
3.已知物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的PH依次为:8,9,10,,则可知对应酸的酸性强弱顺序为( )
A.HX > HY> HZ B.HX > HZ > HY
C. HY> HZ > HX D. HZ > HY > HX
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com