
15.
(1)C (2)CuCO3或CuO或Cu(OH)2(3)
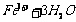
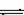
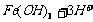
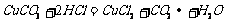
(4)加入浓盐酸或在HCl气氛中.
第16课时 (B卷)
纠错训练
14.
(1)阴离子 阳离子 2c(Na+)+c(H+)=2c(CO32-)
(2)2c(Na+)=2c(CO32-)+2c(HCO3-)+2H2CO3
(3)c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
8.B 9.C 10.A 11.AD 12.D
讲析:7.仅③中含磷元素,必须有③,有③则不能有⑤,两者反应生成沉淀,P元素不被吸收,用④则不能用①,两者双水解降低肥效。 10.NH4Cl是可溶性的盐,属于强电解质,在溶液中完全电离NH4Cl=NH4++Cl-。因为NH4Cl是强弱碱所生成的盐,在水中要发生水解;NH4++H2O
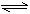 NH3·H2O+H+,所以[NH4+]比[H+]及[OH-]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl-]>[NH4+]>[H+]>[OH-]。 11.对C项可这样理解:当稀释到一定程度时,[H+]将不再发生变化,其值为10-7mol/L,但在继续加水的情况下,[CH3COO-]将继续降低,所以,
NH3·H2O+H+,所以[NH4+]比[H+]及[OH-]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl-]>[NH4+]>[H+]>[OH-]。 11.对C项可这样理解:当稀释到一定程度时,[H+]将不再发生变化,其值为10-7mol/L,但在继续加水的情况下,[CH3COO-]将继续降低,所以,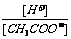 的值应随着水的加入而不断变大。
的值应随着水的加入而不断变大。
13
|
条件 |
平衡移动方向 |
Fe3+的水解程度 |
pH |
|
|
浓度 |
加FeCl3(s) |
向右 |
减小 |
减小 |
|
加水 |
向右 |
增大 |
增大 |
|
|
温度升高 |
向右 |
增大 |
减小 |
|
|
加HCl |
向左 |
减小 |
减小 |
|
|
加少量的NaOH |
向右 |
增大 |
增大 |
|
|
加Na2CO3 |
向右 |
增大 |
增大 |
1.C 2. C 3. A 4.C 5.C 6.D 7.B
4.现象为:产生白色沉淀,且红色褪去。
原因:在纯碱溶液中,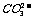 ?水解,
?水解,
讲析: ,溶液呈碱性,加入酚酞后溶液呈红色;加入BaCl2后,
,溶液呈碱性,加入酚酞后溶液呈红色;加入BaCl2后,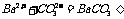 (白色),由于c(
(白色),由于c(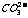 )减小,水解平衡左移,c(OH-)减小,酚酞褪色。
)减小,水解平衡左移,c(OH-)减小,酚酞褪色。
新活题网站
2.两溶液恰好完全反应后得到甲酸钠溶液,由于甲酸根的水解,HCOO-的浓度比Na+的浓度变小,溶液呈碱性,故应选A。 3. NaHSO4是强酸的酸式盐,可以不考虑水解。其余的盐都要考虑盐的水解
1.B D 2.A 3.C
讲析:1.此题实质上是0.05mol/L的HCN溶液和0.05mol/L的NaCN溶液的混合溶液。由电荷守恒关系可得:
c(H+)+c(Na+)=c(CN-)+c(OH-) (1) 由于c(OH-)﹥c(H+)可知B选项正确
由物料守恒关系可得:
c(HCN)+c(CN -)=c(Na+)×2=0.01mol/L (2)
(2)可知D正确。且c(Na+)>c(CN-)即c(HCN) ﹥c(Na+)>c(CN-),所以A选项错。
将(1)×2+(2)可得:
2c(H+)=c(CN -)+2c(OH-)-c(HCN) (3)
C选项错误。
26.(1999年全国高考)二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A=H++HA-, HA-=H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,
最小的是 。
(2)c(H2A)最大的是 ,
最小的是 。
(3)c(A2-)最大的是 ,
最小的是 。
25.在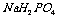 溶液中存在的平衡有(用离子方程式表示):____________________
_。
溶液中存在的平衡有(用离子方程式表示):____________________
_。
设计一实验说明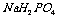 的电离程度比水解程度大_________________________
。
的电离程度比水解程度大_________________________
。
24.浓度相同的下列各种溶液PH值由小到大的顺序是:________ __。
①HNO3 ②H2SO4 ③H2CO3 ④KOH ⑤Ba(OH)2 ⑥Na2CO3 ⑦KNO3 ⑧AlCl3 ⑨CuCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com