
23. < 10-8 a+b=14 b>7>a
22.甲同学正确,根据电荷守恒原理,c(M+)+c(H+)=c(A-)+c(OH-),因溶液呈中性,即c(H+)=c(OH-),所以(M+)=(A-)。
21. (1)④>②>①>③>⑤ (2) ⑤ (3) ③④⑤
(4)
20.(1)
(2)不同意,因BiOCl中Cl为-1价而不是+1价
(3)将BiCl3溶解于含适量HCl得蒸馏水中
(4)增大溶液中Cl-浓度,抑制了BiCl3得水解
19. c(CO32-) c(OH-) c(HCO3-)
17.B 18.AC
讲析:7.

 8. CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
8. CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
10. BD 11. CD 12. D 13. A 14.AB 15. B 16.C
1. BC 2.B 3. A 4.B 5.BC 6.C 7.D 8.B 9.D
2.两种物质的电荷平衡关系分别如下:
NaF: [Na+]+[H+] = [F-]+[OH-]-----------①
NaCN: [Na+]+[H+] = [CN-]+[OH-]---------②
因为HF比HCN易电离,所以NaF的水解程度比NaCN水解程度小,在这两种溶液中,NaF溶液中的[OH-]比NaCN溶液中的[OH-]小,反之, NaF溶液中的[H+]比NaCN溶液中的[H+]大;由于[NaF]与[NaCN]相同,即[Na+]相同,推知①左边大于②式左边, ①式右边也大于②式右边,所以可得: [Na+]+[H+]+[F-]+[OH-]>[Na+]+[H+]+[CN-]+[OH-]。
检测提高
1.BD 2.B
讲析:1.本题考查学生对盐溶液中离子之间的几种守恒关系--即物料守恒、电荷守恒、质子守恒
提示一:根据电荷守恒和物料平衡,可得:
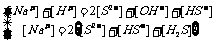 ,化简,可得到B选项是正确的
提示二:OH-有两个来源,一是水电离得到的,这部分与水电离出来的H+的物质的量相等;二是由硫化钠水解得到,每产生一个OH-,同时就有一个‘H’被阴离子结合而生成HS-或H2S,所以水解生成的HS-和H2S中的‘H’与水解生成的OH-的量是相等的,故可列出下式:
[OH-]=[OH-]水解+[OH-]水电离=[HS-]+2[H2S] +[OH-]水电离=[HS-]+2[H2S] + [H+]
提示三:溶液中存在着下列关系:
S2-+H2O
,化简,可得到B选项是正确的
提示二:OH-有两个来源,一是水电离得到的,这部分与水电离出来的H+的物质的量相等;二是由硫化钠水解得到,每产生一个OH-,同时就有一个‘H’被阴离子结合而生成HS-或H2S,所以水解生成的HS-和H2S中的‘H’与水解生成的OH-的量是相等的,故可列出下式:
[OH-]=[OH-]水解+[OH-]水电离=[HS-]+2[H2S] +[OH-]水电离=[HS-]+2[H2S] + [H+]
提示三:溶液中存在着下列关系:
S2-+H2O HS-+OH-
HS-+OH-
x-y x
HS-+H2O H2S+OH-
y y
[OH-]=[OH-]水解+[OH-]水电离
=x+y+[OH-]水电离
=x-y+2y+
[H+]
=[HS-]+2[H2S]
+ [H+]
H2S+OH-
y y
[OH-]=[OH-]水解+[OH-]水电离
=x+y+[OH-]水电离
=x-y+2y+
[H+]
=[HS-]+2[H2S]
+ [H+]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com