
4.下图各容器中盛海水,铁会在其中发生变化。按铁极腐蚀的速度由快至慢的顺序为
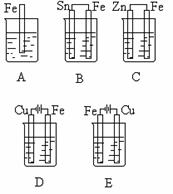
(本题考查学生对金属腐蚀的快慢的判断能力)
新活题网站
3. 在装有水的烧杯中,用线(绝缘)悬挂一个呈水平方向的由铁和银焊接而成的柱形金属棒,处于平衡状态.如果向水中加入CuSO4 溶液, (溶液的密度变化不考虑)
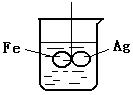
(1)片刻后可观察到的现象是(指悬吊的金属圈) ( )
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是
__________________________________________________。
(本题考查原电池的工作原理,要正确判断正、负极)
2.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是: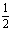 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气是负极
(本题考查学生在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。)
1.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
(本题考查学生书写电池电极反应的能力和利用信息处理问题的能力)
3. 腐蚀的快慢的判断方法
电解原理引起的腐蚀>原电池原理引起的腐蚀>有防腐措施的腐蚀;同一种金属:强电解质>弱电解质>非电解质。
典型题点击
2.金属腐蚀与防护
化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
含义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程 |
|
得失电子 |
金属直接将电子转移给由氧化性的物质 |
活泼金属将电子间接转移给氧化性较强的物质 |
|
电流 |
无电流产生 |
由微弱的电流产生 |
|
腐蚀现象 |
金属单质 |
较活泼金属 |
|
事例 |
金属与O2、Cl2等物质直接反应 |
钢铁在潮湿的空气中倍腐蚀 |
1. 理解原电池的原理
(1)原电池的定义:把化学能转化为电能的装置叫原电池。
(2)构成条件:
①活泼性不同的两电极②电解质溶液③具有闭合回路
(3)工作原理(电子流向)
较活泼的金属材料作为负极,失去电子,经外电路流向较不活泼金属,再经电解质溶液回到负极,构成闭合回路,电流反向流动
(3)正、负极判断:
负极:电子流出的电极,为较活泼金属电极,发生氧化反应
正极:电子流入的电极,为较不活泼金属或非金属或金属氧化物,发生还原反应
(4)电极反应
电极反应 本质 现象
负极 Zn-2e-=Zn2+ 氧化反应 溶解
正极 2H++2e-=H2↑ 还原反应 气泡
总反应 Zn+2+= Zn2++H2↑
(5)用:①制各种电池;②判断反应速率;③判断金属的活泼性;④金属防护。
26.(1)A D (2) C D (3)D A
讲析:反应后的C溶液为:0.01 mol·L-1H2A、0.01 mol·L-1 NaHA和0.01 mol·L-1 NaCl的混合液。因HA-的存在抑制了H2A的第一步电离,所以c(H+)小于A溶液中c(H+),但c(H2A)大于A溶液c(H2A)。反应后D溶液为0.01 mol·L-1的Na2A溶液,所以c(A2-)最大,但因其水解,c(H+)最小。
25.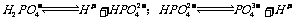

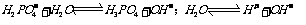
取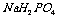 溶液,用
溶液,用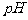 试纸测溶液的
试纸测溶液的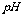 ,得
,得 ,说明
,说明 的电离程度大于其水解程度。
的电离程度大于其水解程度。
24. ②①③⑨⑧⑦⑥④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com