
14.呈现红色的部位发生了2H++2e = H2,而导致H+浓度下降,致使[OH-]>[H+],所以A是负极,B是正极
15. 负极:答:Zn-2e = Zn2+、反应类型:氧化反应;
正极:2NH4++2e = 2NH3+H2、反应类型:还原反应 16.甲溶液的PH值大于乙溶液的PH值。甲:Fe-2e = Fe2+(负极)、2H2O+O2+4e = 4OH-(正极);乙: Fe-2e = Fe2+(负极)、2H++2e = H2(正极)
13.是钾、B是铜、C是银、D是铁、E是锌、F是铂、G是锡
12.(1)电化学腐蚀;铁锅材料为铁合金,其中铁和少量碳及NaCl残液构成原电池。(2)2Fe-4e-=2Fe2+(2分);2H2O+O2+4e-=4OH-;
Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3+(n-3)H2O=Fe2O3·nH2O
11. O2+2CO2+4e 2CO32-,2CO+O2 2CO2
1.AD 2.B 3.C 4.D 5.C 6. B 7.BD 8.D 9.D 10.D
3.
|
|
正极反应 |
负极反应 |
电池总反应 |
pH变化 |
|
(1) |
2H2O+O2+4e-=4OH- |
H2+2OH--2e-=2H2O |
2H2+ O2=2H2O |
变小 |
|
(2) |
H2S+8OH--6e-=SO32-+5H2O |
O2 |
变小 |
|
|
(3) |
CO+4OH- -2e-=CO32-+2H2O |
2CO+O2+4OH-=2CO32-+2H2O |
变小 |
|
|
(4) |
CH4+10OH- -8e-= CO32-+7H2O |
CH4+2O2+2OH-=CO32-+3H2O |
变小 |
|
|
(5) |
C2H4+16OH- -12e-= 2CO32-+ 10H2O |
C2H4+3O2+4OH-=2CO32-+4H2O |
变小 |
|
|
(6) |
C2H2+14OH- -10e-=2CO32-+8H2O |
2C2H2+5O2+8OH-=4CO32-+6H2O |
变小 |
检测提高
2.(1) ② (2)①③ (3) ①③ (4) ②③
1.AC 讲析:通过此题的训练可以达到全面掌握有关原电池工作原理、电极反应、电子流向等知识点,同时该题也是一个将课本知识与实际结合的极好例子。
判断原电池的正负极,可以从两个方面:①微观:电子流出的一极是负极,电子流入的一极是正极。②宏观:活泼的电极是负极,不活泼的一极是正极,电子是从负极沿导
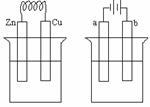
12.(1)原电池。Zn-2e = Zn2+;2H++2e = H2
(2)O2,电解池。2Cu2++4e = 2Cu,4OH--4e =2H2O+O2,降低。
装置连接如图:
第17课时(B卷)
纠错训练
11.(1)原电池中的氧化反应
(2)碳粉:构成原电池的正极;NaCl:起电解质溶液的作用
(3)负极:2Fe-4e-=2Fe2+
正极:2H2O+O2+4e-=4OH-
4Fe(OH)2+O2+2H2O=4Fe(OH)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com