
12.(1)HCl
(2)
(3)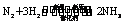
11.(1)CuCl2水解;Cu2++2H2O Cu(OH)2+2H+,使溶液呈酸性。(2)电解时,Cu2+可在阴极放电析出Cu,随c(Cu2+)降低,Cu2+的水解平衡左移,导致溶液中c(H+)下降,溶液的升高。(3)溶液的PH降低 因阳极上产生Cl2,一部分Cl2溶于水后发生反应:Cl2 +H2O
Cu(OH)2+2H+,使溶液呈酸性。(2)电解时,Cu2+可在阴极放电析出Cu,随c(Cu2+)降低,Cu2+的水解平衡左移,导致溶液中c(H+)下降,溶液的升高。(3)溶液的PH降低 因阳极上产生Cl2,一部分Cl2溶于水后发生反应:Cl2 +H2O H++Cl-+HClO,故使溶液中c(H+)增大(主要矛盾),即溶液PH降低。
H++Cl-+HClO,故使溶液中c(H+)增大(主要矛盾),即溶液PH降低。
10. (1)E接D、C接A、B接F F→B→A→C→D→E (2)2Cl--2e=Cl2↑ 变蓝色
Cl2+2I-=2Cl-+I2↓ (3)①③④⑥ (4)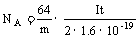
9.(1)64、2、3;(2)负;(3)1。
讲析:(1)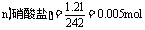 ,含金属M也为
,含金属M也为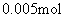 。M的原子量
。M的原子量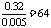 。
。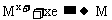
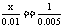 解得:
解得: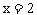 188 + 18 n =242,n = 3。(2) 因为金属在A极析出,所以A极是电解池的阴极,则C极是电源的负极。
188 + 18 n =242,n = 3。(2) 因为金属在A极析出,所以A极是电解池的阴极,则C极是电源的负极。
(3)有0.01mol电子通过电极,就有0.01mol OH-放电,在溶液中就生成0.01mol H+。
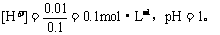
8.(1)先析出白色沉淀,后溶液变蓝。H2SO3+H2O+Ba2+-2e-==BaSO4↓+4H+;2I--2e-==I2 。(2)2HI== H2↑+I2 (3)SO2(H2SO3)的还原性显著比I-强,故前者在阳极上优先氧化,且因存在Ba2+而更易氧化。
6.通电后a极板增重,表明溶液中金属阳离子在a极板上放电,发生还原反应析出了金属单质,因此可确定a极板是电解池的阴极,与它相连接的直流电源的x极是负极。选项C中x极为正极,故C不正确。A中电解液为CuSO4溶液,阴极a板上析出Cu而增重,阳极b 板上由于OH-离子放电而放出无色无臭的O2,故A正确。B中电解液为NaOH溶液,通电后阴极a上应放出H2,a极板不会增重,故B不正确。D中电解液为CuCl2溶液,阴极a板上因析出Cu而增重,但阳板b板上因Cl-离子放电,放出黄绿色有刺激性气味的Cl2,故D不正确。 7.计算过程中可以不考虑电解前溶液中少量NaOH,因为PH值等于10时所含的NaOH的量非常少。
1.B 2.BD 3.B 4.AC 5.C 6.A 7.D
讲析:1.在阴极铜离子放电,得电子的总量=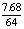 ×2=0.24摩。设B极中含有铜x摩、Zny摩,,则有:
2x+2y
= 0.24----------①
再根据Zn与Cu的质量差可知:当溶液的质量增加0.03时,进入溶液的Zn的物质的量为0.03摩,也就是说y=0.03---------②所以,x=0.09
注:此题很容易犯的一个错误是误将B极中铜的物质的量算成
×2=0.24摩。设B极中含有铜x摩、Zny摩,,则有:
2x+2y
= 0.24----------①
再根据Zn与Cu的质量差可知:当溶液的质量增加0.03时,进入溶液的Zn的物质的量为0.03摩,也就是说y=0.03---------②所以,x=0.09
注:此题很容易犯的一个错误是误将B极中铜的物质的量算成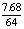 =0.12摩,从而错选A,致所以易出此错,其原因是没有注意在阴极析出的7.68克铜不全来自A极,其中有一部分是在A极溶解锌时电解质溶液中铜离子参与的反应所致! 2.蓄电池放电时起原电池作用,原电池的负极是较活泼的金属,A正确。放电时,Fe是原电池的负极,Fe失电子被氧化成Fe2+离子。由于负极--Fe的附近聚集较多的Fe2+离子,电解质溶液中的阴离子向负极移动,D不正确。充电时蓄电池起电解池作用,充电时电源的负极应与蓄电池的负极(Fe,此时作为电解池的阴极)相连接,发生还原反应:
=0.12摩,从而错选A,致所以易出此错,其原因是没有注意在阴极析出的7.68克铜不全来自A极,其中有一部分是在A极溶解锌时电解质溶液中铜离子参与的反应所致! 2.蓄电池放电时起原电池作用,原电池的负极是较活泼的金属,A正确。放电时,Fe是原电池的负极,Fe失电子被氧化成Fe2+离子。由于负极--Fe的附近聚集较多的Fe2+离子,电解质溶液中的阴离子向负极移动,D不正确。充电时蓄电池起电解池作用,充电时电源的负极应与蓄电池的负极(Fe,此时作为电解池的阴极)相连接,发生还原反应: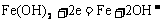 。C正确。该蓄电池的放电和充电时的电极反应分别是:
。C正确。该蓄电池的放电和充电时的电极反应分别是:
放电:负极 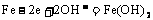
正极 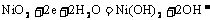
充电:阴极 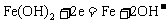
阳极
可见反应是在碱性溶液中进行的,B不正确。
2.(1)正;(2)Ag、2.16;(3)2∶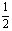 ∶1;(4)不变、不变、增大、减小;(5)45.18。
∶1;(4)不变、不变、增大、减小;(5)45.18。
讲析:电解5.00%的稀H2SO4,实际上是电解其中的水。因此在该电解池的阴极产生H2,阳极产生O2,且 。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336mL气体中,
。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336mL气体中,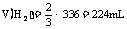 ,为0.01mol,
,为0.01mol,
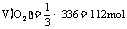 ,
,
为0.005mol。说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生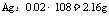 ,即 0.02mol的Ag。则n(e) ∶n(Ag) ∶n(O2)
∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶
,即 0.02mol的Ag。则n(e) ∶n(Ag) ∶n(O2)
∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶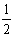 ∶1.
∶1.
由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+离子的物质的量,等于Ag电极被还原给溶液补充的Ag+离子的物质的量,因此[AgNO3]不变,溶液的pH也不变。电解5.00%的H2SO4溶液,由于其中的水发生电解,因此[H2SO4]增大,由于[H+]增大,故溶液的pH减小。
设原5.00%的H2SO4溶液为xg,电解时消耗水0.01×18 = 0.18g,则: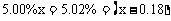 ,解得:
,解得: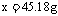 。
。
检测提高
1.D 讲析:与A卷中的第10题仅一字之差,结果完全不同,原因是同样在阴极生成a摩氢气时,前者消耗的H2O为a摩,而此题中被消耗的H2O为2a摩,被电解的H2O与w克Na2SO4·10H2O晶体中的“H2O”刚好可将w克Na2SO4·10H2O晶体中的“Na2SO4”溶解并形成饱和溶液:
H2O的质量=36a+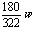 克 Na2SO4的质量=
克 Na2SO4的质量=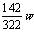 克
所以, 剩余溶液的质量分数
克
所以, 剩余溶液的质量分数
= =
=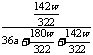 ×100%
×100%
0.3mol 0.2mol 0.3mol 0.15mol
即 48g 5.4g 29.4g 4.8g
② 依CuSO4的溶解度可知
100gH2O 20g CuSO4
240g 48g
生成③其中有5.4gH2O参与了电解过程,余下的水为 240-5.4=234.6的H2SO4为29.4g。故所得H2SO4溶液重 234.6+29.4=264g,其体积为:264/1.074=245.8mL。
电解后溶液的物质的量浓度为0.3mol/0.2458L=1.22mol/L。
(2)10mL l.22mol/L H2SO4稀至1000mL,含有0.0244mol H+,取出25mL中只有0.0061mol H+。依下式:设需NaOH的体积为x。0.0061=0.2x
解得:x =0.0305L。 即30.5mL。
第18课时 (B卷)
纠错训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com