
4.电解含下列离子的水溶液,若阴极析出相等质量的物质,则消耗的电量最多的是 ( )
A.Ag+ B.Cu2+ C.Na+ D.Pb2+
(本题考查电解过程中电子转移情况,涉及氧化还原反应的计算)
3.下列关于铜电极的叙述正确的是 ( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
(本题考查学生原电池和电解池中的电极材料)
2.用石墨电极电解某酸、碱或盐的溶液时,在相同的条件下,阴阳两极收集到的气体的体积比是2∶1,则下列结论正确的是 ( )
A.阴极一定是H2,阳极一定是O2
B.电解后溶液的pH一定变大
C.电解后溶液的pH一定不变
D.电解后溶液的浓度一定变大
(本题考查学生电解规律)
1.下列过程需通电后才能进行的是 ( )
A.电离 B.电解 C.电化腐蚀 D.电泳
(本题考查了四个基本的概念)
4.将1L含有0.4mol CuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后,在一个电极上得到0.3mol Cu,另一电极上析出气体(在标准状况下)的体积是多少?此时溶液的pH值是多少?
(本题考查学生电解产物的计算和溶解度的计算能力)
新活题网站
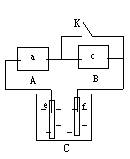
2.(2002高考试测题)右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,
电极f上发生的反应为: ,槽中盛放的镀液可以是 或 (只要求填两种电解质溶液)。
(本题考查学生判断电解池的阴、阳极,书写电极反应式总反应方程式)
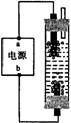 3.(2002上海高考)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
3.(2002上海高考)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
(本题考查电解原理及其应用,是一道包括电极判断、实验观察、综合分析能力在内的综合题)
1.(2003全国高考江苏卷)用惰性电极实现电解,下列说法正确的是 ( )
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
 (本题考查电解产物和溶液pH的计算)
(本题考查电解产物和溶液pH的计算)
2.电解原理的应用
(1)电解饱和食盐水制取氯气和烧碱:
食盐水中一般混有Mg2+、Ca2+、SO42-等离子,电解前须净制以除去这些杂质离子电极材料
电极反应式:阳极(石墨): 2Cl--2e-=Cl2↑
阴极(钢铁):2H++2e-=H2↑
总反应为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(2)电镀:①电极:阳极-镀层金属 阴极-待镀金属(镀件) 电镀液- 含有镀层金属离子的溶液 ②电镀特点:阳极本身参加了反应,而电镀过程中电镀液的浓度
(3)精炼铜
以精铜作阴极,粗铜作阳极,电解硫酸铜水溶液,阳极粗铜溶解,阴极析出铜,电解液浓度基本不变。
典型题点击
1.理解电解原理
(1)电解的定义:将电能转化为化学能的装置
(2)电解池中的阴、阳极判断:
阳极:与电源正极相连的极,在阳极上发生氧化反应。
阴极:与电源负极相连的极,在阴极上发生还原反应。
离子移向:阴离子移向阳极,阳离子移向阴极
(3)电解时电极产物的判断
①阳极产物判断
首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电解时电极溶解,溶液中的阴离子不能失电子。如果是惰性电极(如Pt、Au、石墨)则要看溶液中的离子的失电子的能力。此时根据阴离子放电顺序加以判断。
阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根
②阳极产物判断
直接根据阳离子放电顺序进行判断,阳离子的放电顺序为:
Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+
13.①Q=I·t=216×103C 相当于2.24mol e
相当于2.24mol e 相对于有1.12mol水被电解了(20.1g水)②从剩余溶液总质量164.8g,知有200g-164.8g=35.2g物质离开溶液,其中有20.1g水被电解,由此可知
相对于有1.12mol水被电解了(20.1g水)②从剩余溶液总质量164.8g,知有200g-164.8g=35.2g物质离开溶液,其中有20.1g水被电解,由此可知 结晶的KOH·2H2O的质量为35.2g-20.1g=15.1g
结晶的KOH·2H2O的质量为35.2g-20.1g=15.1g 结晶的KOH的质量为:
结晶的KOH的质量为: ×M(KOH)=9.2g
×M(KOH)=9.2g 结晶水的质量为:
结晶水的质量为: ×2M(H2O)=5.9g
×2M(H2O)=5.9g 剩余溶液的质量分数为:
剩余溶液的质量分数为: ×100%=55.1%
×100%=55.1%
③试题最终要求电解槽的温度。根据上面的计算结果,每100g溶液里有55.1g KOH,利用表知T应在20-30℃之间。现要求具体温度即不是温度范围,故有:利用此温度间的温度与溶解度呈线性关系,故:T=273-20-[ ×10]K=300.7K=27.7℃
×10]K=300.7K=27.7℃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com