
2.(2002·上海高考)水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
(本题为信息题,考查学生的应变能力)
新活题网站
1.(2001·全国高考)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
 ②装好实验装置。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图),导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
⑴如何检查装置的气密性?
⑵以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量简内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
⑶测量收集到气体体积时,如何使量简内外液面的高度相同?
⑷如果实验中得到的氧气体积是c L(25℃、1.0×105Pa)的,水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=
(本题以氧气的制取为切入点,较全面的考查化学实验)
4. 掌握氢气的性质、制法、用途
⑴化学性质:①可燃性:2H2+O2
 2H2O
2H2O
H2+Cl2 2HCl ②还原性:CuO+H2=Cu+H2O
2HCl ②还原性:CuO+H2=Cu+H2O
CH2=CH2+H2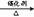 CH3-CH3
CH3-CH3
⑵制法:实验室制法:Zn+H2SO4=ZnSO4+H2↑
工业制法:电解水、电解食盐水、水煤气法等。
⑶用途:充灌气球、冶炼金属、燃料、化工原料
典型题点击
3.水的性质、组成、污染与防治及与人类关系
⑴分子组成和结构:水分子是由一个氧原子和两个氢原子通过极性共价键形成的折线型的极性分子;固态时为分子晶体(氢键晶体)。
⑵物理性质:无色液体,密度为1g/cm3(4℃时)、沸点100℃(溶沸点高的原因是存在氢键作用)
⑶化学性质:①水是极弱电解质 ②水参加氧化-还原反应有以下四种情况:水做还原剂:2F2+2H2O=4HF+O2
水做氧化剂:2Na+2H2O=2NaOH+H2
水既做氧化剂,又做还原剂:2H2O
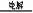 2H2↑+O2↑
2H2↑+O2↑
水既不做氧化剂,又不做还原剂:Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑
③水化反应:CaO+H2O=Ca(OH)2、SO3+H2O=H2SO4、
CH  CH+H2O
CH+H2O CH3CHO。
CH3CHO。
④水解反应:无机盐水解,如NH4Cl水解:NH4++H2O
NH3•H2O+H+ 有机物如酯、卤代烃水解、蛋白质水解等
⑷工业三废、生活污水排放、农药化肥的任意施用是水污染的原因。
2. 握氧气的性质、制法、用途
|
物理性质 |
无色、无味,密度大于空气,难溶于水 |
|
化学性质 |
性质活泼,常做氧化剂 |
|
制法 |
工业上:分离液态空气 实验室:加热KClO3、KMnO4固体 |
|
用途 |
提供呼吸和支持燃烧 |
1. 解空气的成分、污染与防治
⑴干燥的空气的成分按体积分数计算,大约是氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%。
⑵排放到空气中的有害物质,大致可分为粉尘和有害气体(主要指二氧化硫、一氧化碳、氮氧化物等)
17.⑴这些汽油完全燃烧产生的热量为:
Q汽油=4.6×107J/kg×15kg=6.9×108J
⑵根据题意知,氢气与汽油完全燃烧产生德热量相同,即
Q氢气=Q汽油 ,需要电解水的质量44.1Kg
16.设a mL水样中含溶解O2的质量为xg,根据有关反应方程式,已知物质与注物质的关系为:
O2 - 2MnO(OH)2 - 2I2 - 4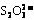 (4分)
(4分)
32g 4mol
xg 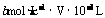
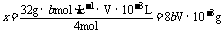 则溶解氧的计算式为:
则溶解氧的计算式为: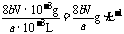
15.(1)2Na2O2+2CO2=2Na2CO3+O2
(2)③ 其一 条件简单,无需加热或通电
其二 该反应能吸收人呼出的CO2产生氧气
14. Cl2与H2O反应生成HClO,HClO具有杀菌和漂白作用,同时Fe2+被Cl2氧化成Fe3+水解生成具有吸附性的Fe(OH)3胶体,吸附水中悬浮杂质而达净水的目的。
Cl2+H2O H++Cl-+HClO 2Fe2++Cl2=2Fe3++2Cl-
H++Cl-+HClO 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3H2O Fe(OH)3(
胶体)+3H+
Fe(OH)3(
胶体)+3H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com