
3.现有用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(0H)2反应制少量漂白粉,现已知反应:
2Cl2+2Ca(OH)2=Ca(C10)2 +CaCl2+2H20(该反应放热)温度稍高即发生副反应:

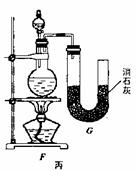
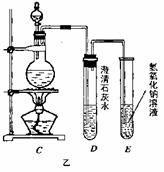 6C12+6 Ca(OH)2=5CaCl2+Ca(Cl03)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示。
6C12+6 Ca(OH)2=5CaCl2+Ca(Cl03)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示。
(1)请从,a不容易控制反应速率; b容易控制反应率; c有副反应发生;d可防止副反应发生; e污染环
境; f可防止污染环境;几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)上图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号) 。
(3)实验中若用1L12mol•l-1浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15mol,其可能的主要原因是
。(假定各步反应均无反应损耗且无副反应发生)。
检测提高
2.1.8g某金属在氯气中燃烧后,质量增加了7.1g,该金属是 ( )
A.Ag B. Fe
C.Al D. Na
1.用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气
( )
A.等于2mol B.等于1mol
C.小于1mol D.大于2mol
4.不能充分、灵活应用氧化还原反应的知识。
纠错训练
3.对实验装置不够重视,没有环境保护意识,容易将装置错误连接,没有尾气吸收装置。实验室制氯气,往往混有HCl和H2O(气)等杂质,必须除去它们(先除HCl再干燥),氯气有剧毒,最后多余的氯气应用烧碱溶液吸收。
2.反应原理掌握不透,错误地认为实验室制氯气可以根据盐酸的量来计算生成氯气的量。MnO2只有与浓盐酸才反应,随着反应的不断进行,盐酸越来越稀,反应将会停止。
1.误认为干燥的Cl2有漂白作用。其实潮湿的Cl2才有漂白性,而真正起作用的应该是HClO,次氯酸盐氧化性很强也有漂白性在酸性条件下性能更强,也是生成HClO的缘故。
10.今有H2、Cl2的混合气体100mL(标准状况下),其中一种气体体积是45 mL,另一种气体体积是55 mL。光照使两种气体发生反应后恢复到标准状况下,气体体积为 mL。为证明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后再恢复到标准状况。若 (1)剩余 mL,证明有 剩余。
(2)溶液有 性质,证明有 剩余。
(本题是简单的过量计算及判断,根据气体定律来计算,并由物质性质确定什么有剩余。)
第20课时 氯气 (B)卷
易错现象
9.将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。
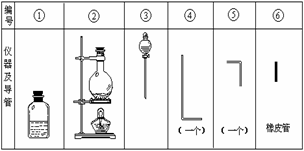
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 。
(3)仪器①的橡皮塞上应有 个孔,原因是
。
(4)实验时,仪器①中除观察到红光外还有
现象。
(5)实验需用约10%的H2O2溶液100毫升,现用市售30%(密度近似为1g/cm3)的H2O2来配制,其具体配制方法是
。
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是:
。
(本题是综合实验题,考查实验室制备氯气的装置连接、新情境实验中的现象分析、溶液的简单配制以及离子方程式的书写等。灵活运用所学知识并结合信息加以分析,答题时语言要简洁流畅。)
8.用滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH(aq)中,当滴到最后一滴时红色突然褪去。试回答下列问题:
(1)实验室保存饱和氯水的方法是
。
(2)产生上述现象的原因可能有两种(简要的文字说明)
①是由于
;②是由于
。
简述怎样用简单实验证明红色褪去的原因是①还是②
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com