
1.D
讲析: HCl与Cl2和干燥蓝色石蕊试纸、干燥有色布条均不作用,通入硝酸银溶液后,均能形成白色沉淀。Cl2与湿润的淀粉碘化钾试纸作用,先置换出I2,碘单质与淀粉变蓝,而HCl无此性质。
9.已知C12在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaCl03的物质的量之比为4:l。现有49.7 g C12,
将其通人到足量70℃的NaOH水溶液中,反应完全后得到500 mL溶液。
(1)写出C12在70℃的NaOH水溶液中符合上述条件的总反应方程式。
(2)计算完全反应后各生成物的物质的量浓度 (除H20外)。
8.G、Q、X、Y、Z均为氯的含氧化合物,它们在一定条件具有如下的转换关系(均未配平):
①G→Q+NaCl;

② Q+H2O X +H2;
③Y+NaOH→G+Q+H2O;
④Z+NaOH→Q+X+H20;
(1)这五种化合物中氯的化合价由低到高的顺序为:
;
(2)由反应②可看出Q、X中氯元素价态的高、低顺序,
所根据的理由是
;
(3)臭氧与二氧化氯作用,可得到红色油状的六氧化二氯(Cl206),遇有机物会爆炸。它与碱溶液反应可得到两种氯的含氧酸盐,代表该反应的是
(填①-④编号)。其离子方程式是:
;
(4)亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存约1年,但在酸性溶液中因生成亚氯酸而发生分解:
5HCl02==4C102+H++Cl-+2H20
分解时,刚加入硫酸反应缓慢,随后突然反应迅速释放出气态的二氧化氯,这是因为 (填序号)。
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出ClO2使反应的生成物浓度降低
7.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
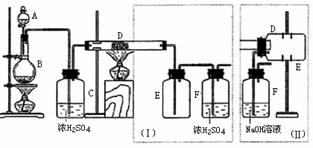
(1)B中反应的化学方程式为:
;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:
;
(3)D中反应化学方程式为:
;
(4)装置(Ⅰ)的主要缺点是:
;
(5)装置(Ⅱ)的主要缺点是: ;
如果选用此装置来完成实验,则必须采取的改进措施是:
。
6.实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如图甲装置来制取Cl2:
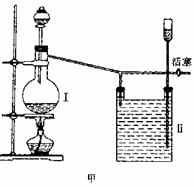
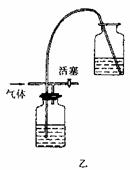
(1)设计甲装置是依据了 (填已学过的某仪器名称)的原理。甲中装置Ⅱ (填“能”或“不能”)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是 。该装置可看作是一个 (填某仪器名称),简述其主要原理:
。
5.下列对氯气的描述中,不正确的是 ( )
A.在标准状况下,氯气的密度是3.17g·L-1
B.实验室不能用排水法收集氯气
C.液氯不导电,是非电解质;氯水能导电,是电
解质
D.不干燥的氯气遇二氧化硫,其漂白性能增强
4.aL标准状况下的H2、Cl2混合气体经光照,充分反应后,所得气体恰好使溶液中bmolNaOH完全转变为盐,则a、b的关系不可能 ( )
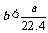
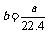
A. B.
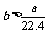
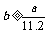
C. D.
D.
3.将0.2molMn02和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
( )
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
2.下列关于漂白粉的叙述中,正确的是( )
A.漂白粉的有效成分是Ca(C10)2和CaCl2
B.漂白粉在空气中久置后能变质
C.漂白粉的溶液呈碱性
D.在使用漂白粉时应用浓盐酸
1.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性 ②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是 ( )
A.Cl2 B.SO2
C.NaClO D.KMn04
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com