
6.(1)启普发生器,能;(2)饱和食盐水,储气瓶,关闭活塞时继续产生的氯气被迫进入Ⅱ,由于氯气在饱和食盐水中的溶解度较小,大部分氯气充满液面上空间内使液体压入漏斗中,保存在瓶Ⅱ中的氯气可以随时开启随时取用。
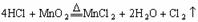 讲析:从题意看该项实验欲制取氯气并对过量的氯气随取随用,由此不难想出启普发生器的原理。从甲中Ⅱ图可以推测这不是一个洗气瓶(进气管太短)而是一个排液瓶,为什么要排液?题意上说多余的氯气随取随用,进而推知Ⅱ中所盛液体必然不能溶解氯气,常用饱和食盐水,即此装置相当于储气瓶。若留意观察不难看出,甲中Ⅱ与乙形异实同。
讲析:从题意看该项实验欲制取氯气并对过量的氯气随取随用,由此不难想出启普发生器的原理。从甲中Ⅱ图可以推测这不是一个洗气瓶(进气管太短)而是一个排液瓶,为什么要排液?题意上说多余的氯气随取随用,进而推知Ⅱ中所盛液体必然不能溶解氯气,常用饱和食盐水,即此装置相当于储气瓶。若留意观察不难看出,甲中Ⅱ与乙形异实同。
1. C;2.B、C;3.C;4.D;5.C、D;
讲析:1.只有NaClO符合3条要求。2.漂白粉是CaCl2和Ca(C10)2的混合物,但其有效成分为Ca(C10)2,A错;漂白粉在空气中发生以下反应而变质: Ca(C10)2+H20+CO2=CaCO3+2HClO;
2HclO=2HCl+02↑ ,B正确;Ca(C10)2为强碱弱酸盐,水解后显碱性,C正确,漂白粉使用时不能使用浓盐酸,因为要发生氧化还原反应:
Ca(C10)2+4HCl(浓)=CaCl2+Cl2↑+2H20, D错。
|
的反应:MnO2+4HCl MnCl2+Cl2↑+2H20可知MnO2过量,则0.6molHCl中最多有0.3mol被氧化,但实际上随着反应的进行,盐酸的浓度变稀,被氧化的HCl必然小于0.3mol,即溶液中Cl-的量必然大于0.3 mol,产生的AgCl的量大于0.3mol,当然小于0.6mol。 4.本题可采用“极值法”,显然H2、Cl2混合气体中Cl2的量越大,消耗的NaOH的量就越大,反之越小,Cl2的极限为aL,此时消耗NaOH物质的量为a/11.2,因Cl2的体积总是小于aL,故答案为D。 5.液氯为单质,氯水为混合物,二者既不是电解质又不是非电解质。不干燥的氯气遇二氧化硫发生反应:SO2+Cl2+2H2O==2HCl+H2SO4,二者漂白性能均减弱。A、B的结论均正确。
3.(1)甲:d,ae 乙:b、f, c 丙b,ce ;
(2)C(F)、B、E;(3)MnO2只能氧化浓HCl,随着反应进行,c(Cl-)减小,还原性减弱,反应不能继续进行。
讲析:本题综合性较强,既要熟悉Cl2的制法,又要抓住题给信息应用理论知识采取相应的实验措施。根据题给药品,制取Cl2应选用装置C或F,依据题给信息Cl2与Ca(OH)2的反应是放热反应,且温度高时易发生副反应,所以制漂白粉时应采取降温措施。Cl2有毒,又需进行尾气处理。
检测提高
1. C;2.C;
讲析:1.若含HCl为4mol的浓盐酸全部反应,生的
氯气为1mol,但是MnO2只有与浓盐酸才反应,随着反应的不断进行,盐酸越来越稀,反应将会停止。故生成的氯气小于1mol。 2.设金属的相对原子量为A,生成的氯化物的化学式为MClx,则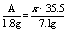 得A=9x可根据金属氯化物MClx中,x应为1,2,3…这样的正整数分别带人代数式中进行讨论:
得A=9x可根据金属氯化物MClx中,x应为1,2,3…这样的正整数分别带人代数式中进行讨论:
当x=1时,M为+1价金属,A=9与选项不符;
当x=2时,M为+2价金属,A=18与选项不符;
当x=3时,M为+3价金属,A=27,为A1元素。
10.100;(1)10,H2;(2)漂白,C12。
讲析:H2、Cl2的反应是左右两边气体体积相等的反应,无论怎样反应,体积都是100mL。H2过量不与水作用,体积为10 mL,而C12过量,有漂白性,但体积小于10 mL。
第20讲 (B卷)
纠错训练
8.(1)在阴凉处置于棕色试剂瓶中密封保存。(2)①氯水与NaOH反应生成两种盐,碱性减弱;②氯水过量后HClO的漂白性将溶液变成无色。向无色溶液中再滴加NaOH溶液,若不出现红色,应为原因②,若出现红色,应为原因①。
讲析:能使变红的酚酞褪色的原因可能是溶液碱性减弱(中和碱性)或氯水过量后HClO的漂白性将溶液变成无色。若设计实验证明褪色的可能原因,最简便的方法是在褪色的溶液中再滴加NaOH溶液,若不出现红色,说明是HClO漂白的结果,若出现红色,说明是中和碱性的结果。
1.D;2.B、D;3.D;4.C;5.B;6.B、D;7.C。
讲析:1.次氯酸盐具有强氧化性,有消毒杀菌作用。3.氯气与NaOH、NaBr、FeCl2作用显示氧化性。通入AgN03(aq),其实是先与水反应产生氯离子,再形成AgCl沉淀。通入Na2C03(aq),也是先与水反应产生酸,再产生CO2气体。 4.Cl2与湿润的碘化钾淀粉试纸变蓝,而HCl不能与之反应,不能检验HCl是否满瓶;Cl2与湿润的蓝色石蕊试纸先变红后褪色,HCl只能变红。用蘸有浓氨水的玻璃棒检验二者现象一样,均有白烟产生,用湿润的红色石蕊试纸不能检验HCl是否满瓶。5.Cl2+ H2O 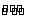 HCl+HClO,该反应是平衡体系,甲瓶中加入少量的NaHCO3晶体将会与HCl反应,平衡右移,c(HClO)增大;乙瓶中加入少量的NaHSO3晶体,HClO与之反应,c(HClO)减小,而丙中c(HClO)不变。 6.Cl2密度比空气大,且肥皂水水解显碱性与它反应。 7.HClO具有强氧化性,与反应生成Cl2: HClO+HCl=C12+H2O,则有下列关系式:
HCl+HClO,该反应是平衡体系,甲瓶中加入少量的NaHCO3晶体将会与HCl反应,平衡右移,c(HClO)增大;乙瓶中加入少量的NaHSO3晶体,HClO与之反应,c(HClO)减小,而丙中c(HClO)不变。 6.Cl2密度比空气大,且肥皂水水解显碱性与它反应。 7.HClO具有强氧化性,与反应生成Cl2: HClO+HCl=C12+H2O,则有下列关系式:
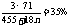 Ca(OH)2·3CaCl(ClO)·nH2O→3C1O-→3HClO→3C12,依题意:
,解得n=8.5
Ca(OH)2·3CaCl(ClO)·nH2O→3C1O-→3HClO→3C12,依题意:
,解得n=8.5
4.(1)2 4 2 2 1 2 H2O ;(2) ② ;
(3)0.2 ; (4)2.63 。
讲析:配平当然用化合价升降法,但必须分析一下本反应,符合“归中”规律,KClO3是氧化剂,ClO2是还原产物,HCl是还原剂,Cl2是氧化产物。而KCl中的氯来自盐酸(这部分盐酸起酸性作用!),缺少的产物一看便知是水。(2)、(3)也就容易了。解第(4)问不可忽视括号中的说明, 1molClO2作氧化剂(变成-1价氯)得5mole-,而1mol Cl2作氧化剂(变成-1价氯)得2mole-,故该答案为: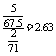 。
。
新活题网站
2.(1)2H++CO32-=CO2 ↑+H2O;
(2)CaCl2、Na2CO3、AgNO3、HCl。
讲析:从丁与乙混合产生无色气体,它们分别是Na2CO3、HCl中的一种,再从①、②信息中得出乙与甲、丙反应均有沉淀生成,确定乙为Na2CO3,丁是HCl。由于丙与丁、丙与甲作用都有沉淀,丙为AgNO3,甲是CaCl2。再代入检验一下,结论完全正确。
|
(2)
(3)Fe+2HCl==FeCl2+H2↑
(4)Cl2+2FeCl2==2FeCl3
讲析:B是黄绿色气体,说明B为Cl2,该题题眼就在此!C是无色气体,能与氯气反应,初步认定它是H2,则它们反应生成的E为氯化氢,E溶液为盐酸,盐酸与A反应又有氢气生成,说明A是金属。根据反应①、④推出A为Fe,代入验证,全部符合。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com