
8.从海水中制取溴的过程是把Cl2通入加热到90℃、pH=3.5的卤水中,将Br-氧化成为Br2,用空气吹出生成的Br2,被Na2CO3溶液吸收得到NaBr和NaBrO3的混合液,再用酸酸化混合液,即可得到Br2。写出有关的离子方程式:
(1)Na2CO3溶液吸收Br2 。
(2)用酸酸化混合液制取Br2 。
(本题考查离子方程式的书写能力,配平时注意先电子守恒再电荷守恒最后质量守恒。)
7.在一定的条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O
(1)RO3n-中R元素的化合价是 。
(2)R元素原子的最外层电子数是 。
(本题考查元素化合价的确定以及化合价与原子核外电子排布之间的关系,可巧用电子守恒来解题。)
6.人体缺碘会影响正常的生命活动,为提高人体素质,食物补碘已引起人们的重视。试回答下列问题:
(1)成年人体内缺碘会产生的病症是 ( )
A.甲亢 B.侏儒症
C.地方性呆小症 D.地方性甲状腺肿
(2)我国缺碘病区甚广,防治缺碘病的主要措施是食盐加碘。1996年我国政府以国家标准的方式规定食盐的碘添加剂是KIO3,不使用KI的原因可能是 ( )
A. KI口感苦涩
B. KI有毒
C. KI在储运过程中易变质
D. KI价格昂贵
(3)可用电解法制备KIO3。其原理是:以石墨为阳极,不锈钢为阴极,以KI溶液(加入少量K2Cr2O7)为电解质溶液,在一定电流强度和温度下进行电解,则阳极反应式为 ,阴极反应式为
;电解总反应的化学方程式为:
。
(本题考查了加碘食盐的有关知识以及电极方程式的书写。解题时要了解缺碘的危害、熟悉KI的性质、掌物电解原理。)
5.把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300mg,则该氯化镁中的杂质可能是 ( )
A.氯化钠 B.氯化铝
C.氯化钾 D.氯化钙
(本题是混合物的计算,可用平均值法或极值法。)
4.甲、乙、丙三种溶液各含一种X-(X-为Cl-、Br-、I-),甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次是( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I- 、Br-、Cl- D.Cl-、I-、Br-
(本题考查了卤素离子的还原性、卤水的颜色及碘单质的检验,解题时要熟知有关卤素知识。)
3.随着卤素原子半径的增大,下列变化规律正确的是 ( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质氧化性逐渐增强
(本题考查了卤族元素的性质递变规律,要根据元素周期律并结合卤族元素的特点理解、熟记!)
2.下列说法正确的是 ( )
A.漂白粉的有效成分是氯酸钠
B.氟化氢在空气中呈现白雾,这种白雾有剧毒
C.碘化钾溶液能使淀粉变蓝
D.氟气通入水中有氧气生成
(本题考查了相关物质的部分性质,熟练掌屋这些物质的性质是解题的基础。)
1.砹是第六周期ⅦA族元素,推测下列单质或化合物的性质中有明显错误的是 ( )
A.砹单质为黑色的固体
B.砹的氢化物不稳定
C.砹单质不易溶于水
D.砹的最高价氧化物的水化物为强酸
(本题考查了砹及其化合物的性质,由卤族元素的有关性质迁移可得出结论。)
4.(2001年上海高考题)为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
(本题考查化学计算的能力,先找出关系式,再列比例解题,可大大简化计算过程。)
新活题网站
3.(1996年上海高考题)(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
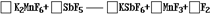
反应中 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素
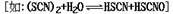 ,它们阴离子的还原
,它们阴离子的还原
性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
①(CN)2与KOH溶液反应的化学方程式:
;
②NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式: 。
(本题考查了氧化还原反应的配平、规律以及知识迁移和应用信息的能力。用化合价升降法配平并结合氯气的一些反应进行迁移。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com