
1.下列关于臭氧性质的叙述中不正确的是( ) ( )
A.臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C.臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂
D.臭氧和氧气一定条件下可以相互转化
(本题考查O3的简单性质,要识记。)
4.(1997年上海高考题)接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的1万米3尾气中含0.2%(体积百分数)的SO2。问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏。(CaSO4·2H2O)
(2)如果将一定体积的尾气通入100毫升2摩/升的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7克溶质。试分析该溶液的成份,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且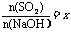
试写出X在不同取值范围时,n(NaHSO3)的值或
n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
|
x |
n(NaHSO3) |
|
|
|
|
|
|
|
|
|
(本题是一道综合计算题,能力要求高,涉及到过量判断及关系式法、极值法、数轴法等多种解题方法。)
新活题网站
3.过氧化氢(H2O2)的水溶液俗名双氧水,医疗上可作外科消毒剂。
(1)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红 色褪至无色,主要原因是双氧水的 性。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫 红色消褪了,此时双氧水表现出 性。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用 双氧水揩擦后又恢复原貌,有关反应的化学方程为:
。
(本题主要考察H2O2的化学性质,从氧元素的化合价来分析入手。)
2.(1)(1996年上海高考题)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式: 、
。
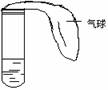 (2)(2000年全国高考题)某学生课外活动小组利用右图所示装置分别做如下实验:
(2)(2000年全国高考题)某学生课外活动小组利用右图所示装置分别做如下实验:
在试管中注入某无色溶液,加热试
管,溶液变为红色,冷却后恢复无
色,则此溶液可能是____________
溶液;加热时
溶液由无色变为红色的原因是:
。
(这两小题实质上都是考查SO2的化学性质。答题时要仔细分析,做到方程式书写合理、语言简洁流畅。)
1.(教育部考试中心1999年试测题)盛有氯化钡稀溶液甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是 ( )
A .甲、乙两试管都有白色沉淀生成
B .甲、乙两试管都没有白色沉淀生成
C .甲试管没有白色沉淀生成而乙试管有
D .甲试管有白色沉淀生成而乙试管没有
(本题考查了多种物质之间的反应,答题时从SO2的性质入手。)
2. 二氧化硫
(1)物理性质:无色、刺激性气味、有毒气体,
密度比空气大,易溶于水(1∶40),易液化。
(2)化学性质:具有酸性氧化物的性质(与水、碱、碱性氧化物等反应)、较强的还原性(与O2、Cl2、Br2、I2等作用)、漂白性。SO2被O2氧化成SO3,SO3常温下是无色固体,熔沸点低,与水放出大量的热。
(3)SO2污染大气,形成酸雨,主要来源于化石燃料的燃烧、含硫矿石的冶炼和硫酸、磷肥、纸浆生产的工业废气。
典型题点击
1. 氧族元素
(1)氧族元素位于元素周期表中的第ⅥA族,包
括O、S、Se、Te、Po五种元素。
(2)相似性:它们的原子最外层有6个电子,最低价为-2价,最高价为+6价(O除外),还有中间价态+4价(O除外);气态氢化物通式为H2R,都有氧化物RO2、RO3(O除外),有含氧酸H2RO3、H2RO4。
(3)递变性:随着电子层数的递增,原子半径逐渐增大,元素的非金属性逐渐减弱,金属性逐渐增强,氧、硫表现出显著的非金属性,硒是半导体,碲能导电;单质熔沸点O2→Te逐渐升高,密度逐渐增大,氧化性逐渐减弱;氢化物稳定性减弱,还原性增强。
(4)硫俗称硫磺,淡黄色晶体,不溶于水,微溶于酒精,易溶于CS2。有较弱的还原性和氧化性(与Fe反应生成FeS)。
(5)臭氧(O3),特殊臭味的淡蓝色气体,密度、溶解度、活泼性、氧化性均大于氧气。具有不稳定性、极强的氧化性、漂白性。与O2互为同素异形体。
(6)过氧化氢(H2O2),是含有非极性键的极性分子。无色粘稠液体,呈弱酸性。具有不稳定性、强氧化性、漂白性和还原性。水溶液俗称双氧水,在实验室可用于制氧气。
15.HBr;2KMnO4+16HBr==2KBr+2MnBr2+5Br2+8H2O;
Br2+2OH-==Br-+BrO-+H2O。(1)75.8;(2)0.045mol/L
讲析:本题先是推断后是简单计算。酸化的KMnO4溶液与A的水溶液共热时,可获得一种棕红色气体产物B,B冷却至室温即凝为液体,可知B为Br2,从而得出A为HBr。
(1)原瓶中为HBr和空气的混合气体,平均式量为:
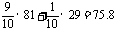
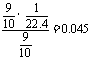
(2)溶液的物质的量浓度为: mol/L。
14.(1)ClO4F;(2)HClO4+F2=HF+ ClO4F;(3)吸收F2、HF,防止污染空气。(4)液氧;使产物固化而而与F2分离。(5)石墨催化使ClO4F全部分解。
讲析:(1)先求最简式再得到化学式;(2)在前一问知道X的基础上很易写出方程式;(3)从题给信息能找出答案;(4)用液氧比液氨好,液氧能使X凝结成固体,分离效果更好。(5)只有从X的完全分解这个角度来考虑,而石墨起催化作用,否则产率不为0。
11.(1)碳或(C)
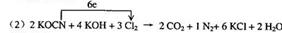
(3)35.5
讲析:(1)标出化合价,碳由+2→+4被氧化。
(2)根据化合价升降法配平。
(3)20L废水中含KCN 0.2mol,由电子守恒知需Cl2 0.5mol。
|
(2)XeF2+2KOH+KBrO3=KBr04+Xe↑+2KF+2H2O。(3)升高。
讲析:前两问用化合价升降法配平,第(3)问由信息进行分析可知:把HBrO3换成含KOH的KBrO3水溶液就得到了很纯的KBr04晶体,说明在碱性条件下易生成BrO4-。
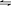
 13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
(2)向含有Cl2的自来水中加入少量液氨,发生反应:
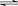 NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
讲析:回答(1)从消毒、净化两方面入手,起作用的到底是什么?又为什么能生成这些物质?而(2)要从题给的平衡以及两物质的稳定性来考虑。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com