
2.原理不清,将SO2的漂白机理与HClO、Na2O2、H2O2、O3的漂白机理和活性炭的吸附作用混为一谈。
活性炭因具有疏松多孔的结构,具有吸附作用,因而与某些色素作用而褪色,是物理变化。
SO2也只能与某些有色物质化合而生成不稳定的无色物质,加热后又恢复成原色,是化学变化。SO2通入紫色石蕊试液先变红,再通也不褪色。
HClO、Na2O2、H2O2、O3等具有强氧化性,氧化有色物质使之褪色,不能恢复原色,是化学变化。
1.通常条件下,SO3是无色固体,容易误认为是气体。
9.已知:Na2SO3+H2SO4==Na2SO4+SO2↑+H2O。实验室有一瓶可能含NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质的Na2SO3,通过下列实验确定该样品的成分及Na2SO3的质量分数。称取样品6.30 g,加入6.0 mol·L-1的硫酸至过量,产生无色气体560 mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得白色沉淀9.32 g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色。请根据实验填写以下空白:
(1)若用下图所示仪器组装进行上述实验,气流从左至右,各仪器的正确连接顺序为 接 , 接 ,
接 ;X溶液是 ,汽油的作用是
。
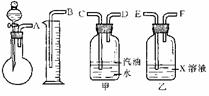
(2)操作时,怎样才能正确地测出放出气体的体积?
(3)若实验中加入硫酸溶液的体积为5.00 mL,则样品中Na2S03的质量分数是 ,一定含有的杂质是 (通过计算回答)。
(本题考查实验装置的连接,如何测量气体的体积,根据方程式进行计算,混合物的判断等。要认真分析实验原理,明确各仪器的作用,由计算进行合理判断。)
第22课时 氧族元素 二氧化硫(B)卷
易错现象
8.已知氧和硫、氧化物和硫化物在化学性质上具有
相似性,用化学方程式分别表示下列变化。
⑴CS2与Na2S溶液一起振荡,溶液由无色变成有色:
。
⑵P2S5与Na2S反应: 。
⑶Na2S2溶于足量稀盐酸中,产生浅黄色沉淀,并放出气体: 。
(本题属于信息题,考查硫化物的性质,抓住信息,将元素转换。)
7.能证明SO2有漂白性的是 ( )
A.酸性KMnO4溶液中通入SO2气体后紫色消失
B.显红色的酚酞溶液通入SO2气体后红色消失
C.品红溶液通入SO2气体后红色消失
D.溴水通入SO2气体后橙色消失
(本题考查SO2的性质,注意比较不同情况下的褪色,透过现象看本质。)
6.下列物质能使品红溶液褪色的是 ( )
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
A.②③④⑤ B.①②③
C.①④⑤ D.全都可以
(本题考查物质的漂白性,要理解漂白原理。)
5. 发现了116号元素R,则下列叙述正确是
( )
①其钠盐的分子式为Na2R;②其最高价氧化物的水化物是强酸;③R是金属元素;④R是非金属元素;⑤其最高价氧化物的分子式为RO3。
A.①③和⑤ B.②和④
C.③和⑤ D.②③和⑤
(本题考查了新元素的性质,要熟练掌握元素周期律和周期表的有关知识。)
4.下列各组属同素异形体的是 ( )
A.16O和18O B.金刚石、石墨和C60
C. O2和O3 D.H2O和H2O2
(本题考查同素异形体的辨析,要熟悉其概念。)
3. 随着核电荷数的递增,下列关于氧族元素(Po
除外)性质的叙述中,错误的是 ( )
A. 固态单质的导电性逐渐增强
B. 元素的非金属性逐渐增强
C. 氢化物的稳定性逐渐减弱
D. 单质的熔、沸点逐渐升高
(本题考查氧族元素的递变规律,要联系元素周期律并熟记!)
2. 过氧化氢沸点比水高,但受热易分解。某试厂
先制得7%-8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是 ( )
A.常压蒸馏 B.加生石灰常压蒸馏
C.减压蒸馏 D.加压蒸馏
(本题考查物质的浓缩方法,答题时要考虑过氧化氢的化学性质。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com