
1.(2001年广东、河南高考题)长期存放的亚硫酸钠可能会部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量a g样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?
其理由是:
。
(2)步骤③中加盐酸使溶液呈强酸性的目的是:
。
(3)步骤⑦的“合格”标准是:
。
(4)实验测得样品中无水亚硫酸钠的质量分数是:
。(列出算式,不需化简)
(本题考查样品纯度的测定,涉及到SO42-的定性、定量检验,答题时要考虑SO32-的干扰、定量实验的要求。)
2. 环境保护
(1)大气污染及防治:主要大气污染物有颗粒物、
硫的化合物、氮的化合物、碳的化合物、碳氢化合物、含卤素化合物、放射性物质等。防治的主要措施有调整能源结构、合理规划工业发展和城市建设布局,运用各种防治污染的技术、制定大气质量标准、加强大气质量监测、充分利用环境自净化能力等。
(2)水污染及防治:主要水污染物有重金属、酸、碱、盐等无机物,耗氧物质,石油和难降解的有机物等。防治的根本措施是控制污水的任意排放。
(3)土壤污染及防治:主要土壤污染物有城市污水、工业废水、生活垃圾、工矿企业固体废弃物、化肥、农药、大气沉降物、牲畜的排泄物、生物残体等。防治的根本措施是控制和减少污染物的排放。
典型题点击
1. 硫酸
(1)物理性质:纯硫酸是一种无色、粘稠的油状
液体,高沸点难挥发,与水任意比混溶,溶与水时放出大量的热。稀释浓硫酸是应将浓硫酸沿玻棒或器壁慢慢倒入水中并不断搅拌。
(2)稀硫酸的性质:硫酸在水中完全电离,具有酸的一切通性。
(3)浓硫酸的性质:浓硫酸中存在大量的未电离的硫酸分子,表现出一些特殊性质。
①吸水性:浓硫酸与水分子结合成水合分子,能吸收湿存水、结晶水等。
②脱水性:浓硫酸能按水的组成比脱去有机物中的氢、氧元素。如有机物中醇类的消去反应、蔗糖的炭化等。
③氧化性:a与金属反应:在加热条件下,大多数金属(金、铂除外)能被浓硫酸氧化,金属被氧化成高价硫酸盐,硫酸被还原成SO2,常温下浓硫酸使Fe、Al钝化,不继续反应;b与碳等非金属反应,在加热条件下将非金属氧化成最高价氧化物,本身还原成SO2;c与低价化合物反应,将它们氧化成高价。
(4)SO42-的检验:在溶液中加入稀HCl(一般不用HNO3)振荡无白色沉淀,在滴入Ba2+(aq)振荡出现白色沉淀,说明存在SO42-。
(5)硫酸的工业制法--接触法:三个阶段、三个反应、三个重要设备;“三废”处理;“废热”的利用;生产规模和厂址的选择。
15.0.91g
讲析:由2 O3==3 O2,可算出O3体积为60mL,则1L气体中含臭氧80 mL。再根据化学方程式进行计算,
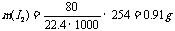
。
14.(1) g/L;(2)蓝,无;(3)偏高;(4)偏高。
讲析:(1)根据题给的三个方程式建立关系式:
O2→4S4O62-,再由关系式进行计算。(2)滴定至终点时无I2存在了,溶液由蓝色变为无色。(3)滴定管蒸馏水洗涤后,未用滴定剂Na2S2O3润洗,会导致它的浓度降低,多用了滴定剂Na2S2O3即V增大。(4)打开塞子加H2SO4时动作缓慢,空气中的氧气将参加反应,多消耗Na2S2O3即V增大。
13.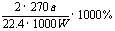 (1)I、G、H、F、E、J(或I、H、G、F、E、J),(2)无色固体;加BaCl2(aq)有白色沉淀产生,加稀硝酸不溶解。
(1)I、G、H、F、E、J(或I、H、G、F、E、J),(2)无色固体;加BaCl2(aq)有白色沉淀产生,加稀硝酸不溶解。
(3)
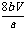 讲析:(1)反应装置从左往右是:发生→收集→量气,装置的接口编号连接顺序不难排出;(2)考查了三氧化硫的物理性质和S042-的检验;(3)根据化学方程式进行计算。
讲析:(1)反应装置从左往右是:发生→收集→量气,装置的接口编号连接顺序不难排出;(2)考查了三氧化硫的物理性质和S042-的检验;(3)根据化学方程式进行计算。
12.(1)向红色消失后的溶液中滴加NaOH溶液,若再出现红色,说明为H202的酸性所致,甲同学的见解正确;若红色不再出现,则为酚酞被氧化所致,乙同学见解正确。(2)将褪色后的溶液加热,若红色再现,通入的是S02,若红色不再现,通入的是Cl2。
讲析:第1问只要证明有没有酚酞存在,而第2问应从二者的漂白原理不同入手。
11.取两份水解产物的水溶液,向一份中滴入品红溶液振荡褪色,证明有S02(或H2S03)生成;另一份中加入AgNO3(aq),振荡得白色沉淀,证明有HCl生成。
讲析:由题意只要证明S02和HCl存在即可。
4.SO2的漂白性与氧化性无关。5.H2S03酸性比H2C03强,SO2通到NaHCO3溶液中发生化学反应:SO2+2NaHC3=Na2SO3+2C02+H20,除去SO2。将气体干燥后再通过加热的铜网除02。6.由氧化还原反应规律知:H2SeO4的氧化性强于Cl2,亚硒酸的氧化性强于亚硫酸,A、C均错。而D中物质的量关系错误。7.此反应过氧化氢中被氧化成氧气。8.用“电子守恒法”解题。9.从反应现象可知:单质的氧化性Br2>I2>S,则还原性S2-> I-> Br-,元素的非金属性Br>I>S。10.与Na化合时,硫显-2价,氯显-1价这与元素原子的最外层电子数有关,与非金属性无关。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com