
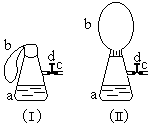
3.(1995年全国高考题)图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为W2克.则W2和W1的关系是 .
(2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是 。
⑶将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。此时瓶内温度 (填"不变"、"降低"或"升高").
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式 。
(此题考查碳酸钙、氢氧化钙、二氧化碳等物质的性质,实验的分析能力)
2.一无色气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下处理(假定每次处理均反应完全):
(1)过碱石灰时,气体体积变小;
(2)通过赤热的氧化铜时,固体变为红色;
(3)通过白色硫酸铜粉末时,粉末变为兰色;
(4)通过澄清石灰水时,溶液变浑浊。
由此可以确定原无气体中:一定含有 ,可能含有 。
(此题考查一氧化碳、二氧化碳等物质的性质,及对该物质性质的灵活运用能力,要求记忆相关物质的性质及特征现象。)
1. 下列关于碳族元素及化合物的性质的描述不正确的是( )
A.除Pb外,+4价化合物是稳定的
B.RO和RO2(除CO2)均不跟水反应
C.RH4的稳定性随相对分子质量增大而增大
D.RH4的沸点从碳到铅逐渐升高
(此题考查碳族元素单质及化合物的相似性和递变性。)
4. (1)碳 碳有金刚石、石墨和C60等同素异形体。
碳在常温下,化学性质不活泼,在高温下,能跟许多物质起反应。碳在氧气或空气中燃烧;碳能跟氧化铜、二氧化碳、水蒸气、浓硫酸反应。
(2)一氧化碳 一氧化碳是无色无味的剧毒气体,难溶于水。
具有可燃性、还原性,如能和氧气、氧化铜、氧化铁反应。
(3)二氧化碳 二氧化碳是无色无味的气体,能溶于水,密度比空气大。
属于酸性氧化物,能和水、氧化钙、氢氧化钙、氧化钠、次氯酸钙等反应。实验室里,用大理石(或石灰石)与稀盐酸制得,工业上用石灰石高温分解制得。
(4)碳酸盐及碳酸氢盐 碳酸盐除钠、钾、铵的盐溶于水以外,其它盐不溶于水。碳酸氢盐都溶于水,其中碳酸氢钠溶解度较小。
它们都可以和盐酸反应。碳酸氢盐不稳定,受热分解;碳酸氢盐和氢氧化钠反应。
典型题点击
3. 该族元素随着原子序数的递增,原子半径增大,得电子能力减弱,失电子能力增强;非金属性减弱,金属性增强;最高价氧化物的水化物的酸性依次减弱,气态氢化物稳定性渐弱。
2. 原子最外层都有4个电子,故该族元素的原子得电子能力较弱,失电子能力也较弱。主要化合价为+2、+4价(其中碳和硅有负价),在化合物中多以+4价稳定(铅在化合物中以+2价稳定)。
1. 碳族元素包括碳、硅、锗、锡、铅五种元素,位于周期表中ⅣA族。
碳族元素包括碳、硅、锗、锡、铅五种元素,位于周期表中ⅣA族。
0.8V,总气体为0.8V+0.2V-x+ 。由题意:

代入x的值,算出SO2的含量为0.0923。
另解:设SO2为X(体积分数),则有
4×(11×X/8+0.0800)=1-0.0800-X
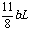 X=0.0923。
X=0.0923。
(4)①SO2为bL,参加反应的O2为 ,反应前
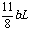
O2共为aL+ ,氮气为其4倍。有:
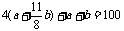
,得13b=200-10a。
②由上式作图比较简单,关键是左端起点的坐标。由提示FeS2氧化时,空气过量20%。设参加反应的空气为V,则过量的空气为0.2V,起反应的O2为0.2V,生成的SO2为0.145V,故0.145V+V=100,V=87.3L。
a=0.2×87.3×0.2=3.5L。
17.(1)308;(2)52;(3)0.0923,
(4)①13b=200-10a;②见下图。
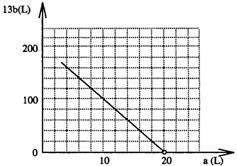
(上图中线段的左端起点为a=3.5,13b=165.)
讲析:(1)根据反应的方程式进行计算。
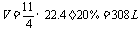
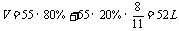
(2)
(3)设参加反应的空气体积为V,实际反应的氧气
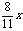
为x,则生成的SO2为 ,过量的O2为0.2V-x,N2为
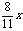
16.17.5 mol·L-1
讲析:溶液稀释到500 mL,再加入足量锌粉,收集到标准状况下气体2.24 L,这是H2,参加反应的硫酸为0.1 mol,用于产生H2的Zn为0.1 mol,固体质量减轻了6.5 g。还有1g的质量差是因为Zn与硫酸铜溶液发生了置换反应,由Zn→Cu,利用差量法可求得这一不参加反应的Zn为1 mol,生成的Cu为1 mol,即与浓硫酸反应的Cu为1 mol,参加反应的硫酸为2 mol。这样硫酸共2.1 mol,则原硫酸的物质的量浓度为17.5 mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com