
4.
|
X 值 |
残留固体 |
|
|
分子式 |
物质的量(摩) |
|
|
0<x1</2 1/2<x<2/3 2/3<x<1 |
Cu、C Cu Cu、CuO |
Ax、A(1-2x) Ax 2A(1-x)、 A(3x-2) |
讲析:氧化铜和碳在加热条件下由于反应物量不同,产物可能得到CO2和Cu,也可能得到CO和Cu。该类型题常用数轴法分区间讨论计算。
新活题网站
3. (1)w2=w1(或回答相等)
(2)Ca(OH)2+2HCl=CaCl2+2H2O (3)升高 (4)2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
(Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,)
讲析:根据质量守恒原理W1=W2(不考虑浮力的影响)n(HCl)=0.12mol n(CaCO3)=0.04mol n(NaOH)=0.15mol 。把CaCO3加入瓶中所得溶液中含0.04molCaCl2、0.04molHCl,加NaOH溶液与HCl反应,由于局部过量,NaOH与CaCl2反应生成Ca(OH)2沉淀。摇动瓶子Ca(OH)2沉淀与盐酸反应而溶解。由于酸碱中和反应是放热反应,所以瓶子内温度升高。此时瓶子里有NaOH、Ca(OH)2与气球中的CO2渐渐反应。
2. 一定含有H2、CO,可能含有CO2、H2O。 讲析:通过碱石灰时,体积变小说明气体中可能有CO2、H2O。通过加热的氧化铜时,固体变红色说明气体可能有CO、H2。白色硫酸铜粉末变蓝色说明有水生成,石灰水变浑浊说明有CO2存在。
1.C、D 讲析:碳族元素除+2价Pb稳定外其余均+4价稳定,故A正确。除CO2外其余氧化物均难溶于水,RH4稳定性与相对分子质量无规律关系,Pb无氢化物。故A、B正确,C、D错误。
9.(97年高考题) 重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
 ③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是 ,理由是:
。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”) ,并简述其理由:
。
(3)通过计算,确定C60分子所含单键数.
C60分子所含单键数为 .
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
C70分子中所含五边形数为 ,六边形数为 。
7.(2002年理综高考题)在25℃,101kPa条件下,15L
O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,
恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中。
V(CO)= L,V(H2)=
解题过程:
(2)若剩余气体的体积为aL,则原CO和H2的混合气中
V(CO):V(H2)= 。
解题过程:
⑶.若剩余气体的体积是a L,则a的取值范围是
。
8(1991年全国高考题).金属锡(Sn)的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为: Sn+2HCl=SnCl2+H2↑
再加入过量FeCl3溶液,发生如下反应: SnCl2+2FeCl3=SnCl4+2FeCl2
最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+离子,反应的化学方程式为: 6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O
现有金属锡试样0.613克,经上述各步反应后,共用去0.100摩/升K2Cr2O7溶液16.0毫升.求试样中锡的百分含量(假定杂质不参加反应
6. (2002年春高考题)从固体物质A开始,可以发生如下框图所示的一系列变化
(2002年春高考题)从固体物质A开始,可以发生如下框图所示的一系列变化
回答下面问题:
在实验室中收集气体B的方法是 (2)操作①的名称是 在操作①中所使用的玻璃仪器的名称是 (3)写出反应②和反应③的化学方程式:
反应②:
反应③: .
(4)A的化学式是 。
 (5)在实验中,如要获得干燥纯净的气体D,可以将它通过如下示意图中的装置,其中瓶Ⅰ中盛放的试剂是瓶Ⅱ中盛放的试剂是收集干燥气体D的方法是
(5)在实验中,如要获得干燥纯净的气体D,可以将它通过如下示意图中的装置,其中瓶Ⅰ中盛放的试剂是瓶Ⅱ中盛放的试剂是收集干燥气体D的方法是
4.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是( ).
A.肯定有KNO3
B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
5. 第ⅣA族元素中,碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的. 锗(Ge)是一种良好的半导体材料,被广泛应用于电子工业上,它可以从煤燃烧的烟道灰中提取,其过程如下:
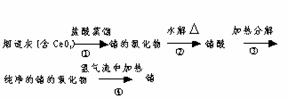
写出①、②、③、④四步反应的化学方程式:
① ,
② ,
③ ,
④ .
3.今有H2和CO(体积比为1:2)的混和气体V升,当其完全燃烧时,所需O2的体积为 ( )
A.3V升 B.2V升
C.V升 D.0.5V升
2.某无色混和气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种依次进行如下处理(假定每次处理都反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊.由此可以确定原混和气体中 ( )
A.一定含有CO2、H2O,可能含有H2、CO
B.一定含有H2O、CO,可能含有CO2、H2
C.一定含有CO、CO2,可能含有H2O、H2
D.一定含有CO、H2,可能含有H2O、CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com