
2、工业废气中氮氧化物是主要的大气污染源之一。
已知2NO2+2NaOH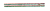 NaNO3+NaNO2+H2O,NO2+NO+2NaOH
NaNO3+NaNO2+H2O,NO2+NO+2NaOH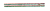 2NaNO2+H2O。现有a mol NO2和b mol NO的混合气,若用足量的NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是
2NaNO2+H2O。现有a mol NO2和b mol NO的混合气,若用足量的NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是
A、a=b/3 B、2a=b
C、a≥b D、a<b
(此题是信息题,考查接受信息的能力,解决问题的能力)
1.下列除去杂质的操作方法正确的是( )
A、NO中有少量的NO2:用水洗涤后再干燥
B、食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C、N2中有少量的O2:通过灼热的铜网
D、红磷中有少量的白磷:加热到40℃,使白磷自燃
(此题考查根据有关物质性质设计实验的能力,要求掌握物质的除杂原理,混合物分离的常见方法。)
6.一种蜡状固体在空气中完全燃烧生成白色粉末X,将X加入冷水中生成含氧酸Y,将X加入热水中生成含氧酸Z,从以上实验现象可判断此蜡状固体是 (写名称和化学式),
X的名称 ,化学式 。
Y的名称 ,化学式 。
Z的名称 ,化学式 。
(此题考查磷及化合物的相互关系,要求能记住磷及化合物的重要性质。)
新活题网站
5.根据元素在周期表中的位置和性质递变规律分析:
(1)氢氟酸为弱酸,水为中性,推断氨水的酸碱性强弱 。
(2)从PH3能自燃,H2S可燃,推断Si H4燃烧的难易
。
(3)As的最高氧化物的化学式是 ,氢化物的化学式是 。砷在它的最高价氧化物的含量是65.2%,砷的原子量是
计算式: 。
(此题考查同周期、同主族元素性质变化规律的运用。)
4.在一定温度和压强下,将一支容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A、3.75mL B、7.5mL
C、8.75mL D、10.5mL
(此题考查NO2和O2溶于水的计算)
3.氮的某种氧化物中,氮元素与氧元素的质量比是
7∶4,此氧化物中氮元素的化合价为
A.+1 B.+2
C.+3 D.+4
(此题考查由元素的质量比计算化学式计算能力)
2.下列物质中,互为同素异形体的是
A、126C和136C B、白磷和红磷
C、磷酸和偏磷酸 D、NO2和N2O4
(此题考查同素异形体、同位素等概念)
1.下列关于氮的叙述中不正确的是 [ ]
A.氮气的性质非常稳定,主要是因为氮氮叁键的键能很大所致。
B.氮是氮族中非金属性最强的元素。
C.氮元素的非金属性强于磷,在化学反应中的活泼性也强于磷。
D.液氮可作冷冻剂,氮元素有多种化合价。
(此题考查氮分子的结构及氮气的性质。)
5. 磷、五氧化二磷
磷有两种同素异形体:白鳞和红磷。白磷分子式为P4,正四面体形,蜡状固体,剧毒,着火点40℃,不溶于水,易溶于CS2,少量白磷保存在水中。
红磷结构复杂,暗红色粉末,着火点240℃,不溶于水和CS2。白磷隔绝空气加热到260℃时转化为红磷,红磷加热到416℃升华后冷却得白磷。
磷的单质都可以与O2、Cl2反应。
五氧化二磷(P2O5)
白色固体,易吸湿,可做干燥剂,为酸性氧化物,是磷酸的酸酐。易与水反应,与热水反应生成磷酸(无毒),与冷水反应生成偏磷酸(剧毒)。
典型题点击
4.氮气
(1) 物理性质
无色无味、难溶于水的气体。空气中78%(体积分数)是氮气。
(2)化学性质
氮分子中含氮氮三键,键能很大(946KJ·mol-1)远大于其它双原子分子,故常温下氮气性质很稳定。在高温下能与氢气、氧气和某些活泼金属(如镁、钙等)反应。
(3) 氮的氧化物(N2O、NO、N2O3、NO2、N2O4、N2O5) N2O3、N2O5是酸性氧化物,分别为HNO2、HNO3
酸酐。NO 是无色难溶于水的气体,不是酸性氧化物。很容易被氧气氧化成NO2,实验室里常用Cu和稀HNO3反应制得。NO2是有刺激性气味的红棕色气体,与H2O反应生成HNO3和NO。氮的氧化物是大气污染气体,常用碱液(NaOH溶液)吸收。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com