
16. 在100ml NaOH溶液中加入NH4HCO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
在100ml NaOH溶液中加入NH4HCO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
(1)NaOH溶液的物质的量浓度
(2)当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为多少升?
(3)当NaOH溶液体积为180mL时,固体混和物的质量为51.6g时,充分反应后,生成气体的体积为多少升?
15.标准状况下的NO2、NH3、H2组成的混合气体11.2L, 通过一定量的稀HNO3溶液, 溶液的质量增加了12.5g, 混合气体体积缩小为4.48L, 求混合气体中各成分分别为多少?
14.(2002年综合试题 )制取氨气并完成喷泉实验(图中夹持装置已略去)。
⑴. 写出实验室制取氨气的化学方程式:
. ⑵. 收集氨气用 法,要得到干燥的氨气可选用
作干燥剂。
 ⑶.用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是
⑶.用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是
该实验的原理是 .
⑷. 如果只提供如图2的装置,请说明引发喷泉的方法。
.
13.人类也可主动地参与氮循环,合成氨工业就是参与上图过程 ①的手段之一,氮肥的生产和使用促进了植物体内蛋白质和核酸的合成,使农业生产取得了飞速发展,以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多优点。 其过程大体如下:

(1)请写出用天然气制备氢气的化学方程式:
(2)写出合成尿素反应的化学方程式:
(3)某工厂以标准状态下的含CH489.6%的天然气100 m3为原料经过上述过程,只生产NH4NO3,不生产尿素, 若生产中氮元素无损失,求最多可制得NH4NO3化肥的质量。
12.(96年上海高考试题).(A)化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1摩NH3,可生成2摩H2,组成化合物E的元素是 和 ;
(3)1摩E和2摩NH3恰好完全反应,化合物E的分子式为 .
11.有一包固体粉末,可能含有下列阳离子或阴离子中的若干种:K+、NH4+、Fe3+、Cu2+、Mg2+、Cl-、SO42-、CO32-、MnO4-。现做以下实验
(1)取少量固体,加适量蒸馏水,搅拌后固体全部溶解,得到无色透明溶液;
(2)在(1)溶液中加入浓NaOH溶液并加热无现象;
(3)再取少量固体,加入稀硝酸,搅拌后,固体全部溶解,没有气体放出;
(4)向(3)溶液中滴入Ba(NO3)2溶液,无沉淀产生。再滴入AgNO3溶液生成白色沉淀;
(5)用铂丝蘸取少量粉末放在火焰上灼烧,透过蓝色钴玻璃观察时,火焰呈紫色。
试根据以上实验现象判断:
这个白色粉末一定含有的物质是 ,一定不含有的离子是 。
10.W、X、Y、Z为原子序数前18号除稀有气体外的四种元素,其原子序数按W、Z、X、Y的顺序增大,其中只有Y为金属元素,Y的最外层电子数与W相等;Y、Z两元素的原子序数之和为W、X两元素质子数之和的两倍;X原子L层电子数是K层电子数的3倍。由此推断:
(1)W、X、Y、Z四种元素的名称分别是:
W: ,X: ,Y: ,Z: .
(2)写出Z与W、Y与X所形成化合物的电子式:
(3)由W、X、Z所形成的离子化合物是 ,它与NaOH溶液在加热条件下反应的离子方程式是 。
9.有A、B、C三种气体, 其相互转化关系为: 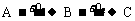 。其中A和B均为无色气体, A和C都易溶于水, 二者的水溶液的酸碱性恰好相反。则A为 , B为 , C为 。
。其中A和B均为无色气体, A和C都易溶于水, 二者的水溶液的酸碱性恰好相反。则A为 , B为 , C为 。
8.由(NH4)2SO4和MgSO4组成的混合物共192克,溶于水中配成10L溶液。测得此溶液中[SO42-]为0.15mol/L,则原混合物中NH4+的物质的量是
A、0.1mol B、0.5mol
C、1mol D、2mol
7.物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl B.NH4HSO4
C.CH3COONH4 D.NH3·H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com