
2. V(CO2)=30mL V(NO)=40mL
V(NH3)=30mL
1.(1)检查装置的气密性。(2)红。蓝。
3CuO + 2NH3
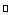 3Cu + N2↑ + 3H2O
, 还原性
3Cu + N2↑ + 3H2O
, 还原性
(3)生石灰溶于水放热,OH-浓度增大,使氨气逸出。
(4)吸收未反应的氨气及水蒸汽。 (5)C。
11.20.8%
讲析:(NH4)2SO4 ~ 2NH3 ~ H2SO4
吸收NH3的n(H2SO4) = 0.11mol
n(NH3)= 0.22mol
N% = 20.8%
第27课时 (B卷)
纠错训练
10.(1)碳酸氢钠,
NaCl+ H2O+ CO2+NH3 = NaHCO3↓ +NH4Cl
(2)CO2在水中溶解度小。(3)引流
 (4)2NaHCO3 Na2CO3
+CO2↑+H2O
(4)2NaHCO3 Na2CO3
+CO2↑+H2O
9.(1)3,3,2,2,16。
(2)HBr,0.5mol
(3)NO, 1,3,4,1,3,1,2。
8. NH4HCO3 讲析:由(1)可知固体是可溶性化合物。由(2)可知固体中含HCO3-或CO32-离子,无Cl-离子。由(3)可知含有NH4+离子。由(4)及前面信息可推固体是NH4HCO3。
7.略
1.AC 2.A 3.A 4.B 5.B 6.C
讲析:2.在酸性条件下,弱酸根离子、氢氧根离子、酸式弱酸根离子不能大量存在,MnO4-离子为紫红色。3.NH4Cl分解生成HCl和NH3,HCl和NH3冷却后又生成NH4Cl。NH4I分解生成NH3和HI,HI不稳定,继续分解生成H2和I2。4.HCl、NH3、SO2完全溶解于水,标准状况下,所得溶液的物质的量浓度为1/22.4mol/L。设NO2体积为1L(标况),则物质的量为1/22.4mol,NO2与水反应生成HNO3和NO,生成HNO3 0.298mol,溶液的体积为2/3L。其浓度为.0446mol/L。 5.氨气和氯气反应生成氯化铵和氮气,其方程式:
8NH3 + 3Cl2 = 6NH4Cl(固体) + N2 根据同温同压下,压强比等于物质的量比。
5.(1)①b,c,a,c,d。
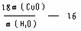 吸收未反应的氨气,防止空气中是水分进入。固体由黑色变为红色。②
③a、c
吸收未反应的氨气,防止空气中是水分进入。固体由黑色变为红色。②
③a、c
(2) a、c
新活题网站
1.A 2.B 3.A 4.C
讲析:1.实验室里用氯化铵固体和熟石灰在加热条件下反应制氨气,也可以用浓氨水加热制氨气。 2.铵盐都溶与水,属于离子化合物,是离子晶体。与碱反应生成氨气。加热分解,不一定产生氨气。 3.铵盐的检验方法是取样品加碱(常用NaOH溶液)加热,产生的气体使红色石蕊试纸变蓝色(氨气的水溶液呈碱性。),可以用酚酞试纸检验。 4.设氨水、水各1升。氨气质量为227.5g,氨水质量:1910g。NH3%=227.5/1910=11.9% 若等质量取氨水和水混,所得溶液浓度为12.5%。等体积取氨水和水混和,水的质量偏多,浓度小于12.5%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com