
3. 0.1mol固体M(NO3)2加热分解,
0.1mol固体M(NO3)2加热分解,
2M(NO3)2 2MO + 4NO2 ↑ + O2↑
将产生的气体用排水法收集,在标准状况下收集到的气体的体积接近
A.5.6L B.4.48L
C.0L D.1.12L
(此题考查信息的接受能力及分析问题的能力。)
2.下列反应中HNO3即表现出酸性,又表现出强氧化性的是
A.Fe2O3+HNO3 B.Ca(OH)2+HNO3
C.P+HNO3 D.FeO+HNO3
(此题考查硝酸的化学性质及应用。)
1. 某单质能与浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是
A +1 B +2
C +3 D +4
(此题考查硝酸化学性质的运用能力。)
4.(96年上海高考题)某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下:
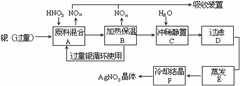 依据上述步骤,完成下列填空:
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀).原因是 .
(a)减少过程中产生NOx的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a) 有利于加快反应速度
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C是为了除去Fe3+、Cu2+等杂质.冲稀静置时发生的化学反应是 。
(a)置换反应 (b)水解反应 (c)氧化-还原反应
产生的沉淀物化学式: .
(此题考查实验设计原理的运用,实验分析能力。)
新活题网站
3. 38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4ml(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0×10-3mol B.1.6×10-3mol
C.2.2×10-3mol D.2.4×10-3mol
(此题考查质量守恒原理、电子守恒原理的运用能力。)
2.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原的硝酸的物质的量之比为2∶1时,还原产物是
A.NO2 B.NO
C.N2O D.N2
(此题考查铜和硝酸反应的性质知识,电子守恒原理。)
1.用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应,(2)铜跟稀硝酸反应,
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是途径(3)>途径(1)>途径(3)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
(此题考查实验的判断能力及计算能力。)
3.硝酸的强氧化性的特殊表现
(1)在利用HNO3的酸性时,必须考虑到其强氧化性,如: 3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
3Na2SO3 + 2HNO3 = 3Na2SO4 + 2NO + H2O
(2)无论浓、稀HNO3均有强氧化性。硝酸越浓,其氧化性就越强。
(3)浓HNO3的氧化性强于稀HNO3。氧化性的强弱是指得电子能力的大小,即指反应的难易程度,而不能用氧化剂得电子的数目多少来衡量。
(4)在与金属的反应中,HNO3不但是强氧化剂,还表现出强酸性,金属与硝酸反应不产生氢气,常用电子守恒原理,质量守恒原理解金属与硝酸的反应问题。
(5)铁在与HNO3反应时,由于有反应:Fe + 2Fe3+ = 3Fe2+,当HNO3过量时,产物为Fe(NO3)3;当Fe过量时产物为Fe(NO3)2;当Fe与HNO3恰好反应时,有可能生成Fe(NO3)2、Fe(NO3)2混合物。
(6)铜与HNO3反应过程中,若铜过量,起始铜与浓HNO3反应生成NO2,反应进行到一定程度时,硝酸渐稀,产物变成NO,最终NO、NO2的混合气体,可通过电子守恒求解,金属与HNO3的反应现象类似铜。
(7)NO3-、H+与S2-、SO32-、I-、Br-、Fe2+离子因氧化-还原反应不能共存。
典型题点击
2.硝酸的化学性质:
(1)强酸性:具有酸的通性。
(2)不稳定性:4HNO3 4NO2 + 2H2O
+ O2
4NO2 + 2H2O
+ O2
硝酸越浓越易分解,因此浓HNO3应存放在棕色试剂瓶中。
(3)强氧化性: HNO3中的+5价N元素具有很强的得电子能力。
HNO3(浓) NO2 HNO3(稀)
NO2 HNO3(稀) NO
NO
如:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
常温下, 浓HNO3使Fe、Al钝化
C + 4HNO3(浓) = CO2 + 4NO2 + 2H2O
王水(浓HNO3与浓盐酸的体积比为1∶3)能溶解Au、Pt。
1.硝酸的物理性质:
纯硝酸为无色有刺激性气味的液体,沸点较低(83℃),易挥发,在空气中遇水蒸气形成硝酸的小液滴而呈白雾状。98%以上的浓硝酸称为“发烟硝酸”,69%的硝酸溶液称为浓HNO3。浓HNO3由于HNO3分解产生的NO2溶于硝酸中而一般呈黄色。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com