
11.NO2、NO、CO2。
Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2H2O
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
10. (0.1+a)mol 讲析:n(Cu)=0.05mol, n(Cu2+)= 0.05mol n(H+)=a mol 由电荷守恒原理可知 n(NO3-)=0.05mol×2 + amol = (0.1+a)mol
9.强氧化性,NO2气体。强氧化性,棕色,阴暗处。
浓盐酸、浓硝酸。3:1。
3.4NO2 + O2 +2H2O = 4HNO3 由该反应可知生成的NO2 、O2恰好反应生成硝酸,无气体余.4. H+、Fe2+、NO3-发生氧化还原反应不能大量共存。H+、HCO3-反应而不能大量共存。 5.Cu与稀H2SO4不反应,加硝酸盐后,Cu、H+、NO3-反应。 8.0.8mol电子转移时,参加反应的Mg为0.4mol,所以HNO3被还原成+1或-3。产物为N2O或NH4NO3。
1.BD 2.D 3.C 4.AD 5.AD 6.C 7.D 8.BC
讲析:1.Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2H2O
C + 4HNO3(浓)=CO2↑+ 4NO2↑ +2H2O
所以单质在反应中显示+2、+4。
4.(1)稀,a、c。 (2)a、c
(3)b ,Cu(OH)2 、 Fe(OH)3 。
新活题网站
3.n(Cu)= 0.0006mol,n(NO+NO2)=0.001mol
所以n(HNO3)=0.0006*2mol + 0.001mol=0.0022mol
2.设参加反应的金属2mol,被还原的硝酸1mol
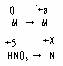 根据电子守恒原理;2a = 5- X
根据电子守恒原理;2a = 5- X
讨论;a=1时,X=3
a=2时,X=1
a=3时,X=-1
1.AC 2.C 3.C
讲析:1.(1)Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2H2O
(2)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
 (3) 2Cu + O2 2CuO,
(3) 2Cu + O2 2CuO,
CuO + 2HNO3 = Cu(NO3)2+H2O
制得1mol Cu(NO3)2需4mol浓HNO3,需8/3mol稀HNO3,Cu先氧化成CuO,再变成Cu(NO3)2,需2molHNO3
13.在100ml混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L,向其中加入5.76g铜粉,微热,使其充分反应。
(1)求溶液中Cu2+的物质的量浓度.
(2)若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度分别是多少?
14(1998年上海高考题).65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏。分别得到97.5%HNO3和60%Mg(NO3)2溶液(不含HNO3)。
(1)若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,求蒸馏前的投料比M1/M2的值。
(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失。则投料时,比值M1/M2应该 (选填增大、减小或不变)。
(计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com