
2.0.1 mol·L-1NaOH和0.1 mol·L-1NH4Cl溶液等体积混合后,离子浓度大小正确的次序是 ( )
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[OH-]>[H+]
C.[Na+]=[Cl-]>[H+]>[OH-]
D.[Cl-]>[Na+]>[OH-]>[H+]
(此题为离子浓度大小的比较题,考查NaOH的性质及弱电解质的电离等知识。)
1.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.3gNa与水反应,产生H2 0.1 NA个
B.1mol O2在反应中作氧化剂时所得电子数一定为4NA
C.1mol钠与水完全反应,被还原的水分子为NA个
D.1mol/L NaOH溶液中所含的钠离子数为NA
(此题考查物质的量和粒子之间的关系计算。)
5. 焰色反应
金属及它们的化合物在灼烧时都会使火焰呈现出特
殊的颜色,叫焰色反应。
钠元素的焰色反应呈黄色,钾元素的焰色反应呈紫
色。在观察钾的火焰颜色时,要透过蓝色的钴玻璃去观察,目的是滤去黄色的光,避免钠的焰色所造成的干扰。
典型题点击
4. 碱金属的化学性质
(1)相似性:
①与O2等非金属反应生成氧化物、过氧化物和超氧化物。②与水反应生成可溶性一元碱和氢气。③强还原剂:M-e- = M+
(2)从锂到铯递变规律:
⑴与O2、H2O的反应逐渐剧烈。⑵金属性逐渐增强。
3. 金属的物理性质
(1)相似性 单质是银白色(铯略带金色)固体,
质柔软,密度小熔点低导电导热性强。
(2)递变规律(从锂到铯)
密度逐渐增大(除K),熔、沸点逐渐降低
2. 碱金属元素的原子结构
(1)相同点:碱金属最外电子层上都只有一个电子,容易失去。
(2)递变规律:随着核电荷数增大,电子层数增多,原子半径逐渐增大。
1.金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)。钫(Fr)是放射性元素,中学里通常不讨论。碱金属是一类化学性质非常活泼的金属,在自然界中都以化合态存在。
17.化肥厂有一个制取水煤气的生产工艺:
C(s)+H2O(l)= CO (g)+H2 (g);ΔH=+131kJ/mol
C(s)+ O2(g)= CO2(g);ΔH=-393kJ/mol
假定要得到2000Kg水煤气,理论上要多少千克空气才能使炉温回到原来的温度?
16.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198 P-O:360 O=O:498 P=O:585
试根据这些数据,计算以下反应的Q
P4(白磷)(g) + 5O2(g) = P4O10(g); ΔH=-Q kJ/mol
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
15.已知X为 和
和 的混合物,取两份等质量的X样品进行下列实验:
的混合物,取两份等质量的X样品进行下列实验:

固体 酸性溶液 无色气体
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为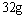 ,溶液E中只含有一种金属离子,气体F在标准状况下体积为
,溶液E中只含有一种金属离子,气体F在标准状况下体积为 ,试计算取用的每份X的质量和X中
,试计算取用的每份X的质量和X中 和
和 的质量比。
的质量比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com