
10.Li,Cs,Cs,Li
1.C 2.D 3.CD 4.AB 5.C 6.C 7.A 8.B 9.D
5.(1)中和过量的硫酸。
(2)白色沉淀是Al(OH)3、Mg(OH)2,当加650mLNaOH溶液时沉淀最大,溶液中恰好是硫酸钠,n(H2SO4)=0.5×n(NaOH)=0.5×1.00mol/L×0.65L=0.325mol
C(H2SO4)=3.25mol/L
(3)Al2O3 、n(Al2O3)=0.05mol
MgO、n(MgO)= 0. 15mol
新活题网站
4.1号液是HCl(0.1mol/L),2号未知液是NaCl(0.1mol/L)。3号未知液是NaOH(0.1mol/L),4号未知液是酚酞(0.1%)。讲析: NaOH(0.1mol/L)和酚酞(0.1%)混合呈红色,NaCl(0.1mol/L)和HCl(0.1mol/L)混合无现象,NaOH(0.1mol/L)和酚酞(0.1%)混合液中加盐酸红色变浅最后消失。
2. NaOH与NH4Cl恰好反应,生成的NH3•H2O,NH3•H2O为弱电解质,电离使溶液成碱性。 3.46mL、1mol/L的盐酸完全生成了氯化钾,所以n(KCl)=0.046mol 固体质量(KCl):3.43g。
1.C 2.B 3.A
讲析:1.2.3gNa生成0.05molH2,H2是0.05NA。1molO2被还原成O22-时需2mole-,被还原成O2-时需4mole-。1mol/LnaOH溶液的体积未知,不能知道Na+的物质的量。
20.30毫升无色混和气体由CO、CO2和O2组成,把这些气体通过Na2O2充分反应后剩余气体是25毫升。引燃25毫升剩余气体冷却到原室温,体积变为20毫升。试确定原混合气体中CO、CO2、O2各多毫升?
19.向10mL、0.2mol/L NaOH溶液中缓慢通入一定量的CO2气体,将溶液在一定条件下蒸干,若得到的白色固体是纯净物,则通入的CO2的体积(标况时)是 mL或
mL。反应的离子方程式分别是 或
。将上述白色固体加水溶解、加盐酸至pH=7,再蒸干溶液,得到的白色固体的质量为 g。(计算过程)
17.如何除去下列物质中的少量杂质,简述操作步骤,写出所加试剂和离子方程式,将正确答案填入下表中。
|
|
操作步骤及试剂 |
化学方程式 |
|
NaCl(Na2CO3) |
|
|
|
NaOH(Na2CO3) |
|
|
|
NaCl(Na2SO4) |
|
|
|
FeSO4(CuSO4) |
|
|
|
KCl(KBr) |
|
|
18(1998年上海高考题).氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
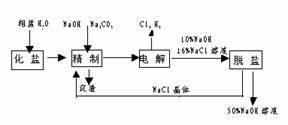
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连
的电极附近,溶液pH值
(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO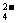 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO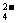 ,该钡试剂可以是 (选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
,该钡试剂可以是 (选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
(4)为有效除去Ca2+、Mg2+、SO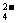 ,加入试剂的合理顺序为 (选填a,b,c多选扣分)
,加入试剂的合理顺序为 (选填a,b,c多选扣分)
a 先加NaOH,后加Na2CO3,再加钡试剂 b 先加NaOH,后加钡试剂,再加Na2CO3
c 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 .
16.金属钠4.6克投入到100克水中,生成溶液的溶质的质量分数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com