
2.(2001年上海高考题)下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 ( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Ba(HCO3)2和Ba(OH)2
(本题考查滴加的顺序不同对反应原理的影响,注意本质上就是量对反应原理的影响)
1.(2002年江苏大综合)等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能是 ( )
A. 甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中铝过量,乙中碱过量
D.甲中酸过量,乙中碱过量
(本题考查铝与酸碱反应时量的问题,答题时注意运用电子得失守恒)
4.铝的化合物⑴AL2O3:白色难熔的物质,不溶于水。典型的两性氧化物,既能跟酸反应,又能跟碱反应。⑵Al(OH)3:
难溶的白色胶状物质,不能使酚酞显色。典型的两性氢氧化物,既能跟强酸反应,又能跟强碱反应。
典型题点击
3. 镁、铝化学性质的对比
镁、铝化学性质的对比
|
|
镁的化学性质 |
铝的化学性质 |
|
与O2反应 |
常温下生成氧化膜,点 燃燃烧  |
常温下生成氧化膜 |
|
与其他非金属反应 |
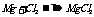  |
  |
|
与H2O反应 |
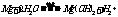 |
除去氧化膜后可与水微弱反应 |
|
与氧化物反应 |
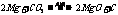 |
8Al+3Fe3O4 4 Al2O3+9Fe |
|
与非氧化性酸反应 |
Mg+2H+=Mg2++H2↑ (与氧化性酸发生复杂反应) |
2Al+6H+=2Al3++3H2↑ (常温下遇浓硫酸、浓硝酸钝化) |
|
与碱溶液反应 |
不反应 |
2Al+6H2O+2NaOH= 2NaAlO2+3H2↑+4H2O |
|
与盐溶液反应 |
Mg+Cu2+=Mg2++Cu |
2Al+3Cu2+=2Al3++3Cu |
2.镁和铝的物理性质 ⑴相同点:密度较小,熔点较低、硬度较小,均为银白色;⑵不同点:铝的硬度比镁稍大,熔、沸点比镁高。
1.镁、铝分别位于周期表中第三周期第IIA族和第IIIA族。镁和铝都是活泼金属,在化学反应中,都易失去电子而成为金属离子,因而镁和铝的性质有相似之处,但由于原子结构不同,镁和铝的性质也有不少差异。
19.c(Mg2+)=1mol/L,c(Cl-)=11mol/L。c(Al3+)=3mol/L

18. (1)0.0167a mol (2)4 b≤a
(3)3b<a<4b 15.6b-3.9a
17.第一种情况:H+、Cl-;K+、Mg2+
第二种情况:OH-、K+;Cl-、NO3-、CO32-。
讲析:铝既能与酸反应放出H2,也能跟碱溶液反应,只要分析在有大量H+存在时可能共存的离子和有大量OH-存在时可能共存的离子,并要求含有该离子的溶液无色即可。
16.⑴ H2O ⑵Na2S ⑶2 Al(OH)3 = Al2O3 + 3 H2O
⑷2H2S + SO2 = 3S + 2H2O
讲析:本题的切入点有两处:⑴D是淡黄色固体单质,可初步认为是S,G是SO2;⑵产物J是含A金属元素的胶状白色沉淀,可初步认为是Al(OH)3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com