
2.在两个烧杯中,各加入相同体积3mol/L的H2SO4溶液,随后分别置于天平左右两个托盘上,调节天平,使之平衡。此时向两烧杯中分别加入10.8g镁、铝,反应完毕后,天平两端将会 ( )
A.不平衡,放铝的一端托盘上升
B.不平衡,放镁的一端托盘上升
C.仍保持平衡
D.无法确定
1.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是①NaHCO3 ②(NH4)2S ③Al2O3 ④Al(OH)3 ⑤Al
A.③④ B.③④⑤ C.①③④⑤ D.全部
3.不能理清镁和铝沉淀变化图像题中反应原理和量的变化关系。解题时要注意以下几点:一是明确反应原理和反应规律;二是弄清图像纵、横坐标的含义,原点、交点,转折点的表达意义;三是定性描述和定量计算相结合。
纠错训练
2.天平上的化学反应对天平平衡的影响题中,不能正确讨论反应物的各种过量情况引起Δm的改变,从而决定托盘的升降或平衡的可能性。
1.误认为Al具有两性或是两性物质。因为Al与碱反应的本质是Al先与H2O反应,生成的Al(OH)3再被NaOH溶解
而促进反应的进行,Al 不直接与NaOH作用。
13.将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。
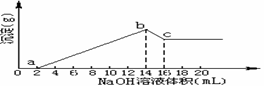
(1)求Mg,Al质量各是多少?
(2)求盐酸的物质的量浓度为多少mol/L?
(本题考查镁铝的综合计算,理清反应原理和图象中各点的含义是解题的关键)
第31课时 镁和铝 (B卷)
易错现象
12.有10.2g Mg、Al混合物,溶于0.5L 4mol/L盐酸中。若加入2mol/L NaOH溶液,使得沉淀量最大,应加NaOH溶液的体积是 L。
(本题考查电荷守恒在计算过程中的应用)
11.已知A为金属单质, 根据下列变化判断A、B、C、D、E各是什么物质?写出有关的化学方程式(离子反应要写离子方程式)
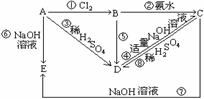
⑴A B C D E
(2)有关化学方程式(离子反应要写离子方程式)
① ②
③ ④
⑤ ⑥
⑦ ⑧
(本题考查铝单质及其化合物之间的转化,金属单质A既能与酸反应又能与碱反应是本题的突破口)
10.(1)由Al3+制Al(OH)3最好的方法是加 ,
写出反应的离子方程式 。
(2)由AlO2-制Al(OH)3最好的方法是通入 ,
写出反应的离子方程式 。
(本题考查Al(OH)3的制备,答题时注意Al(OH)3是两性氢氧化物)
9、将AlCl3和NaOH两溶液等体积混合,得到的沉淀和溶液含铝量相等。则原AlCl3溶液和NaOH溶液的物质的量浓度之比可能是 ( )
A.1:3 B.2:3 C.1:4 D.2:7
(本题考查铝盐和碱反应的计算,答题时注意按两种情况讨论)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com