
2.(1)Mg(镁),H2(氢)
(2)3Mg+N2  Mg3N2
Mg3N2
(3)O2+2NO = 2NO2
讲析:解本题的突破口,可以尝试从棕色气体I着手,若考虑它是NO2,则H和A就应考虑分别是NO和O2,这样C应为N2,B的首选当然是Mg(因为Mg分别与O2和N2反应时,其化学计量关系均满足题中条件),再根据题中C与D反应生成E的计量关系,可判断D为H2。这样可以将图中每种物质都确定下来,它们是:A为O2,B为Mg,C为N2,D为H2,E为NH3,F为Mg3N2,G为MgO,H为NO,I为NO2,J为H2O。再进行有关反应的化学计量关系的检验,都符合题意,故以上答案正确无误。
1.(1)H2 (2)HF、H2O、NH3、NO。
(3)①2F2+2H2O====4HF+O2
|
 4NO+6H2O
4NO+6H2O
|
 5N2+6H2O
5N2+6H2O
讲析:有关的概括性指导语揭示的知识点是粒子的化学式与所含电子数关系这一模式的识别。要找电子数相同的分子,可考虑同一周期的气态氢化物分子。根据重组CH4、NH3、H2O、HF都是含有10个电子的化合物分子,从而判断D是H2。①式说明A单质比B单质活泼,可用已有的化学知识经验模式尝试确定以下三种可能:(1)A:F2 B:O2 (2)A:F2 B:N2 (3)A:O2 B:N2。结合②③反应式作合理推想,力求前后兼顾,可推证A是F2,B是O2,同时也可以引申证实C、X、Y、Z、W分别是N2、HF、H2O、NH3、NO。
6. (1)Fe3O4、Na
(1)Fe3O4、Na
 (2)①8Al+3Fe3O4 9Fe+4Al2O3
(2)①8Al+3Fe3O4 9Fe+4Al2O3
②3Fe+4H2O Fe3O4+4H2
③2Al+2OH-+2H2O===2AlO2-+3H2↑
讲析: I的焰色反应呈黄色,I中含有Na+;由转化关系知Na+来自于G溶液。C为常见单质,D是无色液体,显而易见是Na与水的置换反应。A、E是常见单质,B、F是常见氧化物,它们发生的也是置换反应,F要能与NaOH溶液反应,单质E能与水反应,可联想到铝热反应,答案不难得出。
第34课时 (B卷)
纠错训练
5. (1)A:Na2SO3 B:BaCl2
(1)A:Na2SO3 B:BaCl2
(2)①:2Cl-+H2O 2OH-+H2↑+Cl2↑
②:BaSO3+Cl2+H2O ==BaSO4↓+2H++2Cl-
③:SO2+Cl 2+2H2O== 4H++2Cl-+SO42-
讲析: A的焰色反应呈黄色,A中含有Na+,C溶液的电解产物之一E为有刺激性气味的气体,中学阶段熟知的为Cl2,氯水与D沉淀反应生成的H沉淀既难溶于水、也难溶于稀酸,可想到H为BaSO4,D为BaSO3,F为具有刺激性气味的SO2气体。
4.(1)
|
|
(3) CaO+3C====CaC2+CO↑
讲析:难溶于水的白色固体Y的式量是100,可推知Y为CaCO3,高温分解产物为CaO和CO2,A与D点燃条件下反应,则D为CO2,A为Mg。与CaO高温下反应的G为单质碳,M与水反应生成的X常用于切割和焊接金属的可燃性气体,可知X为C2H2,其他问题不难解决。
3.(1)Fe2(SO4)3、Na2SO4 (2)催化剂、适宜温度
(3)Fe2O3+6H+=2Fe3++3H2O
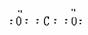 讲析:由G和KSCN溶液混合后溶液显血红色,可知G中含有Fe3+。A是硫酸盐,A和G元素组成相同,则G为Fe2(SO4)3,A为FeSO4。硫酸亚铁受热分解产生B、C、D,且C和D元素组成相同,C与O2反应转化为D,C、D中都含氧元素,C与H2O能反应,可确定C为SO3,D为SO2,其他问题可迎刃而解。
讲析:由G和KSCN溶液混合后溶液显血红色,可知G中含有Fe3+。A是硫酸盐,A和G元素组成相同,则G为Fe2(SO4)3,A为FeSO4。硫酸亚铁受热分解产生B、C、D,且C和D元素组成相同,C与O2反应转化为D,C、D中都含氧元素,C与H2O能反应,可确定C为SO3,D为SO2,其他问题可迎刃而解。
2.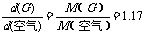 (1)Ⅲ族和Ⅵ族 (2)Al2S3 (3)2/3mol
(1)Ⅲ族和Ⅵ族 (2)Al2S3 (3)2/3mol
讲析:因
故M(G)=1.17×29=34,初步假定气体G为H2S(相对分子质量为34)。按题中框图,逆向推断,调用自己掌握的有关化学知识,尝试写出相应的反应方程式,即可求证。
如果对有关元素及其化合物的性质掌握较熟悉,而对空气的平均相对分子质量为29记忆不清,按题图示,正向演绎,也可殊途同归,得出正确解答的。
1.A:NH3·H2O,D:Al2(SO4)3,E:NaHCO3,F:NaOH,B:MgCl2,C:稀H2SO4
讲析:此题的突破口是实验(3)中的现象,由此可知E,D分别是Al2(SO4)3和NaHCO3中的一种。由限定的推断范围可知,实验(2)中放出的无色刺激性气味的气体必是NH3,则F应为NaOH,D与A的反应中必有NH4+生成。
4.(1)H2 (2)H2O (3)②,④
2NaCl + 2H2O 2NaOH+ H2↑+ Cl2↑
2NaOH+ H2↑+ Cl2↑
2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
讲析:根据已学的知识,常见的工业生产反应有:煅烧石灰石、生产玻璃和水泥、接触法制硫酸、氨氧化制硝酸、氯碱工业等。结合反应条件和反应类型可知,作为工业上生产化合物D的反应①,高温下的分解反应为煅烧石灰石生产生石灰的反应。反应②为电解条件下,两种反应物和三种产物,则溶质和溶剂都参与反应,且产物中有两种单质,联想到电解食盐水的氯碱工业,此题不难解决。
新活题网站
3.(1)N2 O2
(2)N2 + 3Mg Mg3N2
Mg3N2
(3)O2 + 2H2 2H2O
2H2O
[或答:(2),N2 + 3H2 2NH3
2NH3
(3)O2 + 2Mg 2MgO。]
2MgO。]
讲析:甲、乙、丙、丁均为单质,由它们两两相互反应所得到的X、Y、Z、W都是二元化合物。条件②是解本题的突破口。甲和丁按1:3物质的量之比反应生成Y,在Y中元素甲呈负价。由此可联想到所熟悉的合成氨的反应:
N2
+ 3H2 2NH3
2NH3
可暂时先认为甲就是N2,丁是H2。甲和丙也按1:3物质的量之比反应生成X,在X中元素甲呈负价,因此,可判断元素丙在X中呈正价;于是可以设想元素丙为金属元素。与氮按3:1物质的量之比反应的金属,中学所学过的前三周期元
素中,应当是金属镁。甲与丙反应生成X的化学方程式为:
N2 + 3Mg Mg3N2
Mg3N2
从以上分析,可以认定甲是N2,丁是H2,丙是Mg;再考虑题给条件③,容易判断乙是O2。于是,乙与丁反应生成W的化学方程式是:
O2 + 2H2 2H2O
2H2O
上述讨论中,若将丙和丁所代表的物质调换一下,仍可满足题意,故有两种可能的正确答案。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com