
1. (1)CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
 CH2=CH2+Br2
CH2=CH2+Br2  CH2Br-CH2Br
CH2Br-CH2Br
(2)b中水面下降,玻璃管中水柱上升,甚至 溢出。
(3)除去乙烯中带出的酸性气体(或除去CO2、SO2)
(4)①乙烯发生(或通过液溴)速度过快。
②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃
2. (1) 金刚石;金刚石属原子晶体,而固体C60不是,故金刚石熔点较高.
(2) 可能;因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
(3)依题意,C60分子形成的化学键数为:1/2(3*60)=90 ;也可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90,C60分子中单键为:90-30=60
(4)设C70分子中五边形数为x,六边形数为y.依题意可得方程组:
解得:五边形数x=12,六边形数y=25
检测提高
16.(1)这两种烃均能使溴水褪色,它们都不是饱和烃。若这两种烃都是烯烃,则燃烧后生成等体积的CO2和H2O(g),可见不符合题意,舍去;若这两种烃均是炔烃或二烯烃,或一种为炔烃一种为二烯烃,则一体积混合气体燃烧后,生成的CO2应比水蒸气多1体积,也不符合题意,舍去。故混合气体应由一种烯烃与一种炔烃(或二烯烃)组成。

 (2)假设1体积混合气体中含炔烃(或二烯烃)CnH2n-2为x体积,含烯烃CmH2m为(1-x)体积。由燃烧方程式有方程组: nx+(1-x)m=3.6 解得 x=0.6
(2)假设1体积混合气体中含炔烃(或二烯烃)CnH2n-2为x体积,含烯烃CmH2m为(1-x)体积。由燃烧方程式有方程组: nx+(1-x)m=3.6 解得 x=0.6
x(n-1)+m(1-x)=3 3n+2m=18。
故混合气体中CnH2n-2与CmH2m体积比为0.6∶0.4=3∶2。
讨论:在3n+2m=18中,m、n为大于2、小于5的正整数,当n=2时,m=6(舍去);当n=3,m=4.5(舍去);当n=4时,m=3(合理)。所以混合烃由C4H6话C3H6组成体积比为3∶2。
第36课时 (B卷)
纠错训练
15.20% 15%
讲析:反应后混合气体的M平均=1.062×22.4=23.8。C2H2、C2H4、C2H6的相对分子质量分别为26、28、30,说明反应后混合气体中还有H2。反应前H2过量,反应后混合气体是由C2H6和H2组成。
 设反应后H2的体积分数为x,则C2H6的体积分数为(1-x),依据题意:2x+30(1-x)=23.8,解之得x=0.221。
设反应后H2的体积分数为x,则C2H6的体积分数为(1-x),依据题意:2x+30(1-x)=23.8,解之得x=0.221。
又 设反应前混合气体体积是AL,则同温、同压下反应后的气体体积为:0.478A/1.062=0.45A(L)。反应后H2的体积为0.45A×0.211=0.1A(L)。C2H6的体积为 0.35AL。

 再设反应前混合气体中C2H4、C2H2、H2分别为aL、bL、cL,根据化学反应方程式有 a+b+c=A
a=0.15A
再设反应前混合气体中C2H4、C2H2、H2分别为aL、bL、cL,根据化学反应方程式有 a+b+c=A
a=0.15A
a+b=0.35A 解得 b=0.2A
c-a-2b=0.1A c=0.65A
原混合气体中C2H4、C2H2、H2 的体积分数分别为15%、20%、65%。
14.A:CH4 B:C3H4
讲析:根据混合气体1mol质量为25.6g,所以烷烃必然为CH4。6.72L气体的质量为7.68g,其中炔烃的质量为4.8g,烷烃的质量为2.88g,物质的量为0.18mol;炔烃的物质的量为0.12mol,摩尔质量为40g/mol,为C3H4
13.
12.设烯烃的体积为x、炔烃的体积为y。
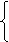
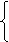 则有 : x+y=aL
x=2a-b
则有 : x+y=aL
x=2a-b
2x+y=bL y=b-a
即可以很轻松的得答案C。
11. 根据烃的燃烧化学方程式:CxHy+ O2
O2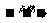 xCO2+
xCO2+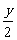 H2O
ΔV少
H2O
ΔV少
1mol (1+y/4)×22.4
xmol 44.8xL

 得y=4。
得y=4。
9.C5H10的同分异构体中能氧化成醛的是:CH2=CHCH2CH2CH3、CH2=CHCH(CH3)2 、CH3CH=CHCH2CH3所以产生醛的种类为5种。注意若烯烃和双键相连的碳原子上若没有H原子,则该烯烃被氧化为酮,而不是醛。
1.A 2.AC 3.C 4.D 5.C 6.B 7.C 8.AC 9.A 10.BD 11.BD 12.C
讲析:1.通过甲烷和乙烯的性质可知答案C、D肯定不可以,而B答案若用液溴则甲烷溶于其中,故也不可以。2.由于乙烯和一氧化碳有相同的相对原子质量,若质量相同,且在相同的条件下有相同的物质的量和相同的体积和密度。3.制取乙烯的原料是用乙醇和浓硫酸,而非3mol/L的硫酸。而且要求温度计在液面下,控制温度在170℃。实验结束时先取出导管后熄灭酒精灯。4.参于加成的H2为100mL,所以炔烃的体积为50mL。故烷烃和炔烃的体积比为150∶50=3∶1。5.根据烃和HCl的体积比可知该烃中含两个双键或一个叁键,再根据加成后产物与Cl2取代的体积比可知加成后产物中含6个氢,及原来产物中含4个氢。 7.可通过化学方程式:
7.可通过化学方程式: 不难看出x=4、y=8。
不难看出x=4、y=8。
3. (1) 1:1:4 1:2:5 1:3:6
(2)n3=3n1 + n2
讲析:设混气平均分子式为CxHy,则:
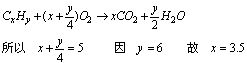 即平均碳原子数为3.5,设C2H6、C3H6、C4H6的比为a:b:c则
即平均碳原子数为3.5,设C2H6、C3H6、C4H6的比为a:b:c则 故c=3a+b,因a、b、c均为小于8、大于0的正整数
所以a=1,b=1时c=4,a=1,b=2时c=5,a=1 b=3 c=6
故c=3a+b,因a、b、c均为小于8、大于0的正整数
所以a=1,b=1时c=4,a=1,b=2时c=5,a=1 b=3 c=6
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com