
1.(教育部考试中心2001年化学试测题) 有三个只含C、H、O的有机化合物A1、A2、A3,它们互为同分异构体。室温时A1为气态,A2、A3是液态。分子中C与H的质量分数是73.3%。在催化剂(Cu、Ag等)存在下,A1不起反应。A2、A3分别氧化得到B2、B3。B2可以被硝酸银的氨水溶液氧化得到C2,而B3则不能。
上述关系也可以表示如下图:
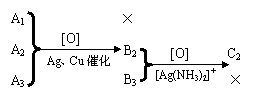
请用计算、推理,填写下列空白:
(1) A2的结构简式 。
(2) B3的结构简式 。
(3) A3 和C2的反应产物 。
(该题考查计算、分析、推理的能力,能力要求很
高。先求出三者的分子式是解题的关键,余下的由关系图可推理得出。而求分子式可以先假设O原子的个数再进行分析、计算。)
3.一元醛有通式:R-CHO,当R-是烷基是称为饱和一元醛,可写成CnH2nO(n≧1)。由于有醛基的存在,醛的化学性质与乙醛类似,还原成醇,氧化成酸,发生银镜反应等。甲醛(HCHO)是最简单的醛,俗名蚁醛,无色、有刺激性气味的气体,易溶与水。用于制酚醛树脂、农药、杀菌、防腐等。
典型题点击
2.乙醛的化学性质可总结为:还原成醇,氧化成酸,有弱氧化性和强还原性。(1)加成反应,主要是与H2加成,碳氧双键断开一个键,再各加上一个氢原子,形成醇,即-CHO变成-CH2OH,加氢或去氧称为还原反应。(2)氧化反应,加氧或去氢称为氧化反应,在有催化剂和加热的条件下与O2作用,生成酸,即-CHO变成-COOH。乙醛还能被弱氧化剂氧化,表现在两个方面①与银氨溶液反应,反应注意事项:试管要洁净、2%的氨水滴入2%的AgNO3(aq)至沉淀刚好溶解制银氨溶液、水浴加热;反应现象:试管上析出光亮的金属--银;反应用途:定性、定量检验醛基的存在,关系式-CHO→2Ag,工业上用于制镜等,实验室洗去银可用稀硝酸。②与新制的碱性Cu(OH)2悬浊液反应,反应注意事项:制Cu(OH)2时碱要过量,加入醛以后要加热至沸腾;反应现象:产生红色沉淀;反应用途:定性检验醛基的存在。
1.乙醛分子式C2H4O,官能团是醛基
(简写为-CHO,不能写成-COH),结构简式CH3CHO。乙醛是一种无色、具有刺激性气味的液体,沸点20.8℃,密度小于水。与水、乙醇、氯仿等互溶。
23.将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
22.将铝放入烧碱溶液中,若反应过程中有0.5mol电子转移,求:(1)参加反应的水的物质的量为多少?
(2)生成水的物质的量为多少?
(3)反应总耗水的物质的量为多少?
21.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
20.亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是 Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O(未配平)
(1)其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘的物质的量为 mol。
(2) 该反应过程和机理复杂,一般认为分以下几步:
①IO3-+SO32-→ IO2-+SO42-(反应慢)
②IO2-+2SO32-→ I-+2SO42-(反应快)
③5I -+6H++IO3-→ 3I2+3H2O(反应快)
④I2+SO32-+H2O→ 2I-+SO42-+2H+(反应快)
根据上述条件推测,此反应速率由 步反应决定。(填序号)
(3)若预先加入淀粉溶液,由反应过程看,必在 离子消耗完时才会有使淀粉变蓝的现象产生,原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com