
3.(1)设每天消耗固体硫的质量为x,根据硫元素守恒得 x×95%=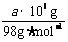 ×32·mol-1×98%
×32·mol-1×98%
x=0.337 a t
(2)每天生产的纯H2SO4的物质的量为 =a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
=a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
V(空气)= ×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
故理论上至少安装送风机的台数=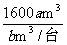 =
=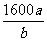 台
台
(3)本小题中“Ψ(O2)的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应,即燃烧前空气中的氧恰好满足S+O2=SO2及2SO2+O2 2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
Ψ(O2)下限=V(空气)×7%/V(空气)=7%
新活题网站
22.4 a /100(L) <V<22.4 a/84(L)
2.(1)二者以等物质的量混合,可求出二者的质量比。m(NaHCO3)︰m(KHCO3)=84︰100
(2)设盐酸的物质的量浓度为z(mol/L)
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 0.1z/2 z=5a/46
如果从KHCO3为基准来计算,可得到同样结果。
(3)盐酸过量时,生成CO2的体积为V:
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 V/2
V=22.4a/92(L)或5.6a/23(L)
(4)如果盐酸不足量,则应该用盐酸的量为基准进行计算,这就需要知道盐酸的物质的量浓度。
(5)可以考虑两个极端时的情况,若全部固体为NaHCO3,可放出CO2 22.4 a/84(L),若全部固体为KHCO3,则可放出CO2 22.4 a /100(L),因此体积范围是:
1.NaCl8.700g、KBr0.500g、CaCl20.800g
讲析:正确分析反应前后物质的变化及质量变化对化学计算至关重要,三种盐的混合物通入氯气后溴化钾转变为氯化钾,并造成反应前后固体的质量差(10.000-9.813)g,由差量法可计算出溴化钾的质量;残留物中仅有氯化钙与碳酸钠溶液反应生成碳酸钙沉淀,由碳酸钙的质量计算出氯化钙的质量。
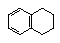
5. 1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
回答下面问题:
(1)下面示意图中的装置,适合步骤①和②操作的是 ;
(2)步骤②中如何判断“反应完全” ;
(3)步骤③中补充少量四氢化萘的目的是 ;
(4)步骤③中过滤后得到的固体物质是 ;

(5)已知在实验条件下,饱各氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中四氢化萘和水的质量比约是1: (保留小数点后1位)。
|
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
(Ⅰ)测定该粉末组成中结晶水的x值;
 (Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(1)见图中已装配好一套装置,回答下列问题:
①该装置用于进行实验(选填Ⅰ或Ⅱ) ,需加热的仪器有(选填序号字母) ;
②在试管D中所放试剂及可观察到的现象是
,
反应的离子方程式为 ;
③为确保反应物有较高的利用率,且使装置中气流平稳,应对C部分进行的改进是 ;
(2)用图中其它仪器组装完成另一实验的装置,回答以下问题:
①这些仪器按气流从左到右方向的连接顺序是(填写序号字母) → → →H;其中H的作用是 ;
②组装试管F时,试管口应略向下倾斜,其原因是
;
(3)若各装置中的反应都能进行完全,实验后测得A中固体质量减轻ag、E增重bg、G增重cg,则表示结晶水x值的计算式为(从a、b、c中选两个量求算,不必化简)
。
4.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
 (3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
 a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
3.选择使用下列仪器、药品验证由铜和适量浓硝酸反应

产生的气体中含有NO(N2和O2的用量可自由控制)
已知:Ⅰ NO+NO2+2OH-=2NO2-+H2O
Ⅱ气体液化温度NO2:21℃, NO:-152℃
(1)现有甲、乙、丙3位同学分别设计了以下3个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
请回答:甲、乙、丙3位同学提出的实验方案是否能验证Cu与适量浓硝酸反应,产生的气体中含有NO(填“能”或“不能”)。
甲 ,乙 ,丙 ;
(2)反应前先通足量N2,其目的是 ;
(3)确认气体中含有NO的现象是 。
2. 实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
|
实验 方法 |
实验过程中所发生反应的 化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关物理量 (用文字说明) |
|
1 |
|
|
|
|
2 |
|
|
|
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
1.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,试设计一个实验方案,既除去杂质,又配成硝酸钠溶液。
供选用的试剂有:①稀HCl ②稀HNO3 ③稀H2SO4 ④NaOH溶液 ⑤Na2CO3溶液 ⑥BaCl2溶液 ⑦Ba(OH)2溶液 ⑧Ba(NO3)2溶液
供选用的实验操作有:A.加热 B.过滤 C.分液 D.蒸发 E.蒸馏 F.结晶
要求:试剂不超过三种,空格按要求填人试剂或操作的序号,可不填满。
实验方案:先将固体溶于蒸馏水配成溶液,然后填下列空格:
选择试剂
选择操作
2.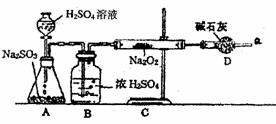 某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由浓H2SO4与Na2SO3反应制取,Na2O2完全反应。
某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由浓H2SO4与Na2SO3反应制取,Na2O2完全反应。
(1)怎样确定反应中是否有O2生成?
;
(2)装置B的作用是
;
装置D的作用是 ;
(3)该同学为了确定另一产物是Na2SO3还是Na2SO4,设计实验如下:
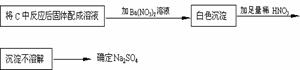
你认为该同学的实验是否合理 ,理由
。
若你认为不合理,请你设计一个合理实验来确定产物(括号内填加入物质,方框内填现象);若你认为合理,可不回答此问。

检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com