
1.(1)依题意,5.74g为AgCl,
n(AgCl)=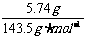 =0.040mol,
=0.040mol,
则:n(BaCl2)=n(AgCl)/2=0.020mol
c(BaCl2)=  =2.00 mol·L-1
=2.00 mol·L-1
(2)由题意知,沉淀质量增加是由BaCO3转化为BaSO4,设BaCO3物质的量为x
BaCO3+ H2SO4= BaSO4+CO2↑+H2O △m
1mol 36g
x 0.18g
 =
=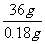 解得:x=0.0050mol n(BaCO3)= n(Na2CO3)=
0.0050mol
解得:x=0.0050mol n(BaCO3)= n(Na2CO3)=
0.0050mol
m(Na2SO4)=1.95g-0.0050mol×106g·mol –1=1.42g
故w(Na2SO4)=  ×100%=72.5%
×100%=72.5%
7.(1)C+CO2= 2CO
(2)Fe、FeO(或名称);CO2
(3)F e、C; CO
(4) (5)
(5)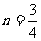
第50课时 (B卷)
纠错训练
6.(1)2CaO2 = 2CaO+O2↑
(2)w(CaO2)=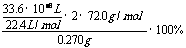 =80%(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×
=80%(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×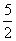
=0.00155mol
 其中CaO2所含的n(Ca2+)=
其中CaO2所含的n(Ca2+)=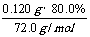 =0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
=0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
 :
: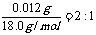 x=
x=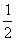
1.A 2.C 3.B 4.B 5.D
讲析:2.将题设情景,用足量的CO还原48.0g氧化物Y的关系式表示如下: Y+CO-CO2-CaCO3
式量 y 28 44 100
实际用量 16.8 26.4 60.0
由关系式中可见足量CO从氧化物样品中夺取了26.4-16.8=9.6g氧,48.0g氧化物中氧占9.6g,金属元素占38.4g,该氧化物中金属元素的质量分数是38.4/48.0=0.80。3.假设等物质的量的硫酸、氢氧化钠溶液与足量的Al完全反应,则产生H2的体积比为2:3 < 5:6,说明乙中铝粉不足,碱过量。4.假设KOH和KHCO3按物质的量之比1:1完全反应, 判断减重情况,与题干比较可得之。
12.45≤W V(CO2)=0
注:30mL HCl(aq)中所含HCl物质的量:
n(HCl)=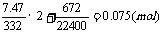
CHCl =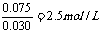
和30mL HCL(aq)完全反应的样品的质量:

样品中Na2CO3和盐酸反应完全生成NaHCO3时(没有CO2放出时),样品质量:
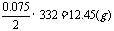
新活题网站
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)
注:V(CO2)=[0.075- ]×22400(mL)也对
]×22400(mL)也对
2.(1) 504
(2)由题意可知,天然碱含NaHCO3、Na2CO3
n(NaHCO3)=2n(CO2)=2×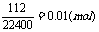
n(Na2CO3)=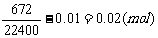
n(H2O)=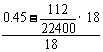 =0.02(mol)
=0.02(mol)
∴天然碱组成:2Na2CO3·NaHCO3·2H2O
(3)2.5
(4)0<W≤4.98 V(CO2)=202.4W(mL)
V(CO2)= 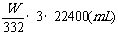 也对
也对
1.(1)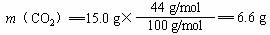
m(CO2+H2O)= 9.3 g m(H2O)=9.3 g-6.6 g =2.7 g
(2)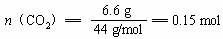
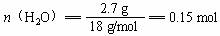
分子中C︰H = 1︰2

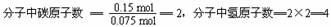
所以该气体的分子式是C2H4
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等)
讲析:因为单一气体为C2H4,现为等物质的量的两种气体之混合物,所以在2 mol混合气体中,应含有4 mol C原子,8 mol H原子,这两种气体可能是C4H6和H2。
22.(99上海)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
21.有一种白色粉末,含有下列阴离子和阳离子中的几种:阴离子:S2-、Cl-、NO3-、SO42-、CO32-、HCO3- 、MnO4-,阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+,将该白色粉末进行下列实验,观察到的现象如下:
|
实验操作 |
现象 |
|
a.取少量粉末,加水、振荡 |
全部溶解、溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠并加热 |
无明显现象 |
|
c.取少量粉末,加盐酸 |
无明显现象 |
|
d.取少量粉末,加稀H2SO4和稀混合液 |
有白色沉淀生成 |
根据实验推断(沉淀A不溶于稀HNO3)
(1)a实验中,可推断粉末中,不可能有 离子;
(2)从b实验中,可推断粉末中,不可能有
离子;
(3)从c实验中,可推断粉末中,不可能有
离子;
(4)从d实验中,可推断粉末中,不可能有
离子,必定含 离子;
(5)综上所述,粉末中还可能含有 离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com