
2、分子式、化学式书写常见错误:⑴元素符号书写不规范,如:Nacl、mgSO4、mnO2等;⑵未遵循化合价法则,如NaCO3、CaPO4、Cu2(OH) CO3等;⑶书写顺序及( )使用不正确,如FH、普通玻璃CaO·SiO2·Na2O、AlK(SO4)2·12H2O、Na(OH)等。
1、未注意离子符号的表达与元素化合价表示方法的区别。
14.某复盐晶体的化学式为AxB(ED4)y·zH2O已知x、y、z均为正整数,且x+y+z=10,用此晶体完成以下实验。
(1)称取晶体40.20克,在坩埚中小火加热至质量不再改变,固体的质量减少10.8克。
(2)将剩余固体全部溶于水配成200mL溶液,取此溶液20mL,向其中加入过量Ba(OH)2溶液后,ED4阴离子和B阳离子全部沉淀出来,经过滤、洗涤、烘干得沉淀5.24克。
(3)往沉淀中加入过量的盐酸,沉淀减少0.58克。试通过计算确定:
① A、B各是什么元素;
② x的值;
③ 此晶体的化学式
(本题考查学生的计算、推理和推断等能力)
第5课时 化学用语 (B卷)
易错现象
13.化合物E(含两种元素)与氨反应生成化合物G和H2。化合物G的相对分子质量约为81,G分子中硼元素(B的相对原子质量为10.8)、氢元素的百分含量分别为40%、7.4%。由此推断:
⑴化合物G的分子式为 ;
⑵反应消耗1molNH3可生成2molH2,组成化合物E的元素是 和 ;
⑶1molE恰好和2molNH3完全反应,化合物E的分子式为 ;
⑷写出化合物E与氨反应生成化合物G和H2的方程式 。
(本题重点考查学生运用知识后的分析、推断能力)
12.下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),黑点代表未用于形成共价键的最外层电子,短线代表价键。
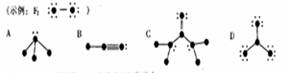
根据各图表示的结构特点,写出该分子的化学式:
A:________ B:_________ C:________ D:________
(本题根据元素原子的成键模型去分析得出成键的原子)
11.有两种气体单质Am和Bn,已知2.4gAm和2.1gBn所含原子个数相同,分子个数比为2:3,又知核内质子数都等于中子数。且A原子中的L电子层所含电子数是K电子层电子数的三倍,试分析判断:
(1)A和B的元素符号分别是 、 ;
(2)Am中m的值是 ;
(3)Am的同素异形体的分子式 ;
(4)B的气态氢化物在加热时可还原CuO为Cu,B变为单质,写出反应的化学方程式是 。
(本题考查学生运用知识的综合分析能力)
10.Fe3O4可写成 2FeO· Fe2O3,若将其看作盐可写成 Fe(FeO2)2,根据化合价规律和以上书写化学式的方法,若将 Pb3O4看成氧化物可表示为 ,看作盐时相应的化学式为 ,分别写出Fe3O4、Pb3O4
与浓盐酸反应的化学方程式
。
(已知Pb4+氧化性远大于Fe3+)
(本题考查一些复杂氧化物中金属元素化合价的本质及氧化物的多种书写形式和其中的某些阳离子氧化性的分析运用)
9.⑴人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:□O2- + □H2O = □ H2 O2 + □O2 + □
⑵0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ热量,其热化学方程式是 。
又知:H2O(l)= H2O(g);△H=+44 kJ·mol-1。则11.2L(标准状况下)乙硼烷完全燃烧生成气态水时放出的热量是
KJ。
(本题考查氧化还原反应的配平,热化学方程式的书写以及反应热的求算)
8.录像用的高性能磁带中的磁粉,主要原料之一是由三种元素组成的CoxFe3-xO3+x的化合物,已知O为-2价,钴和铁可能呈现+2价或+3价,且上述化合物中,每种元素都只有一种化合价,则x的值为 ,铁的化合价为 ,钴的化合价为 。
(本题运用讨论法判断元素的化合价)
7.在化合物X2Y和YZ2中,Y的质量百分比分别约为40%和50%,则在化合物X2YZ3中Y的质量百分比约为 ( )
A.20% B.25% C.30% D.35%
(本题注意由元素的质量分数求出元素原子的质量比,再由Y作桥梁应用于化合物X2YZ3中)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com